抑郁症是一种常见的精神卫生疾病, 主要表现为情绪低落,思维迟缓和言语动作减少,可显著影响个体的身心健康、社会交往、职业能力及躯体活动[1]。据WHO估计的最新数据显示,全球约有3.5亿抑郁症患者。2014年《nature》杂志报道了全球抑郁症流行病情况,其中中国的抑郁症患病率为3.02%[2]。
抑郁症对于国家卫生保健是一个巨大的经济负担,同时也会降低病人的生活质量。目前,对抑郁症的治疗主要包括药物治疗、心理治疗和物理治疗[3]。药物治疗主要应用抗抑郁药来改变大脑内部化学物质的不平衡,但是目前可用的抗抑郁药物通常无效,即使有效也需要4~6周才能显示改善。心理治疗通过心理介导来改变认知习惯和思维方式,对于轻度抑郁作用明显。物理治疗主要是电痉挛疗法,用电流激发神经系统放电可以快速缓解抑郁症,但需要长时间服用药物维持。目前一般的治疗方案是三者结合使用或交替使用。因为抑郁症的产生和实现抗抑郁都与脑部相关回路的变化有关,而目前对抑郁症病理生理的基础了解甚少,发病机制不够明确,目前的治疗方式效果都不尽人意,存在耐受性和各种副作用。近年来光遗传学和化学遗传学的出现为明确抑郁症的机制提供了可能,为治疗抑郁症提供新的方法。
1 光遗传学简介光遗传学(Optogenetics)是集光学、遗传学、分子生物学、药理学和行为学为一体的一项新兴生物工程技术,也称光基因工程。光遗传学在特定的神经细胞中注射含有光敏感蛋白(又称视蛋白)基因的载体病毒,转入光感基因,细胞表达光敏感蛋白后再植入光纤导管,然后通过选定不同波长和频率的光进行刺激来改变蛋白功能,进而调控靶神经细胞[4]。
光敏感蛋白根据功能分为激活神经元的光敏感蛋白、抑制神经元的光敏感蛋白和控制体内G蛋白偶联信号的光敏感蛋白[5]。最常用的激活神经元的光敏蛋白是视紫红质-2 (channelrhodopsin, ChR2),从蓝绿藻中提取,被蓝色(450~490nm)最大地激发, 是一种非选择性的阳离子通道, 当阳离子流入神经元时导致细胞膜的去极化,启动动作电位(图 1)。最近,红移通道视紫红质蛋白(VChR1) 已经被开发,主要感应580nm的黄光。ChR1 / VChR1嵌合体(C1V1) 系列可以增加膜表达, 具有更强的光电流,使它更适合于刺激神经回路[6], 从而增加了在不同实验中激发神经元或去极化的可行性。ChR2的双突变体(Asp156Ala和Cys128Ser)-SSFO是一种新的视蛋白, 有一个实质的改进:具有更强的光敏感性,去极化更快[7]。抑制神经元的光敏感蛋白常用的有盐细菌视紫红质(halorhodopsin, NpHR)对黄绿光敏感,是一种阴离子通道[8]。当激活时,NpHR将氯化物从细胞外泵入细胞质,导致细胞膜超极化并可以减少神经元放电。细菌视紫红质(bacteriorhodopsin, BR)是一种离子通道蛋白[9],把质子从细胞质转运到细胞外。光抑制也可以通过使用外向质子泵来实现,例如Arch,是一种从原始细菌中提取的光敏感蛋白,被560nm波长最大地激活,可以使细胞膜超极化,降低兴奋性。控制体内G蛋白偶联信号的光敏感蛋白(OptoXRs)[10],它的视蛋白受体嵌合体中的视紫红质的细胞内环被来自其他G蛋白偶联受体(如肾上腺素能受体)的细胞内环代替,在哺乳动物内光靶向激活神经元,引发特异性G蛋白偶联信号级联,导致细胞兴奋,膜去极化。光敏感蛋白根据结构又可以分为Ⅰ型光敏感蛋白和Ⅱ型光敏感蛋白[11]。Ⅰ型光敏感蛋白是单成分视蛋白,Ⅱ型光敏感蛋白偶联到G蛋白上才能对光产生效应,这样组合使G蛋白偶联受体(GPCR)成为一种光遗传工具,可以用来调控神经元。

|
图 1 光敏感蛋白的简要分类 注:激活神经元的光敏蛋白有ChR; 抑制神经元兴奋性的光敏蛋白有halorhodopins (HR)和BR等; 控制细胞内G蛋白偶联信号转导通路的光敏蛋白有OptoXRs(视紫红质与配体门控G蛋白偶联受体的结构嵌合体) |
把光敏感蛋白基因注射到体内或细胞内通常利用病毒载体,常用的病毒是腺相关病毒、慢病毒。将荧光蛋白基因、启动子、目的基因通过基因工程整合到质粒载体上构建含有光敏感蛋白的载体作为光遗传学工具。让光敏感蛋白在体内作用的方式还有转基因动物和Cre重组酶体系[12]。转基因动物一般是在胚胎时期将外源基因转入体内。目前已经用于光遗传技术的Cre重组酶体系有胆碱乙酰转移酶-Cre(CHAT-Cre)、小清蛋白-Cre(PV-Cre)[13]。
光遗传实验对发射光源有严格要求,要可以快速调制波长并能够精确定位。目前光遗传技术大多使用的光源有激光,发光二极管(LEDs),白炽光源[14]。最近已经开发无线LEDs,将光传输进入大脑,允许动物的全方位运动,可以提供更好的空间分辨率。见图 2。
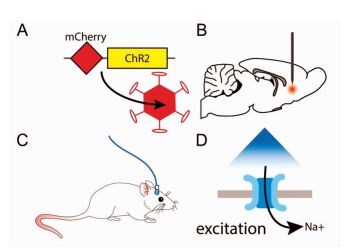
|
图 2 光遗传学实验基本步骤(以ChR2为例) 注:A光敏感蛋白整合到病毒载体B将病毒载体注射到靶细胞C将光纤导入到研究动物体内D刺激光敏感蛋白,检测信号变化 |
化学遗传学(Chemogenetic)是设计生物大分子(如:核酸杂交体、激酶、多种代谢酶和GPCR等)与以前未被认识的小分子生物化合物相互作用的一种方法,来描述观察到的突变对酶底物特异性的影响[15]。将这些蛋白质引入到一个特异性区域之后,化学遗传工具的应用可以导致细胞活动变化。最先出现的化学遗传工具是只能被合成配体激活的受体(receptors activated solely by synthetic ligands, RASSLs),但因为其配体特异性弱等原因没有得到广泛的使用[16]。第2代出现的RASSLs是基于人类毒蕈碱性乙酰胆碱受体活化而成,又被称为只由特定药物激活的受体,其相应的技术被称为药物遗传学技术,药物遗传学技术已成为应用最广泛、效果最好的化学遗传学技术[17]。
药物遗传学技术(designer receptor exclusively activated by designer drugs, DREADDs)是广泛使用的化学遗传工具,可以远程控制细胞信号、神经元活动和行为。DREADDs已被证明对于探究细胞(如:神经胶质细胞、胰腺β细胞和肝细胞等)中的细胞信号是非常有用的[18]。目前的DREADDs,由氯氮平-N-氧化物(抗精神病药物氯氮平的代谢物,CNO)来抑制或兴奋神经元,并且可以通过Gi,Gq,Gs或β-arrestin级联调节细胞信号传导。
毒蕈碱性乙酰胆碱受体家族分为5个亚型,分别标记为M1~M5。M1、M3和M5受体偶联Gq/11蛋白,其激活导致去极化和放电,而与Gi/o蛋白偶联的M2和M4受体导致超极化和抑制神经元[19]。hM3Dq的激活刺激M3与G蛋白(Gq/11) 结合,启动相应信号通路,同理hM4Di的激活刺激M4与G蛋白(Gi/o)结合。基于胰腺β细胞的化学遗传学以及通过激活中等多刺神经元活性的Gs蛋白家族使用基于嵌合大鼠毒蕈碱受体的Gs-DREADD(rM3D)实现。此外,通过失去与Gq蛋白家族结合能力的大鼠M3受体基础上产生的DREADDs,可以在体外选择性靶向Arrestin信号通路(图 3)。至今,没有关于激活G12蛋白家族的DREADDs的报告。
DREADDs操作步骤:确定合适受体,通过病毒(如:启动子特异性腺相关病毒(AAV))注射或转基因动物(如:表达hM3Dq的转基因小鼠)或二者联合使用的方法把遗传信息传递给特定细胞,控制CNO给药时间和方式,检测细胞膜内外电压变化或动物行为。
DREADDs已被证明可以控制各种神经元的活动,包括谷氨酸能,血清素能,多巴胺能和GABA能神经元。DREADDs也被用于控制胶质细胞调节自主神经系统的活动[20]。总之,化学遗传学DREADDs方法几乎为所有GPCR信号通路提供了一个选择性操纵的机会,它不仅用作神经生物学工具,还涉及药物开发的药理研究。DREADDs技术已成功应用于各种体内研究以控制GPCR信号。
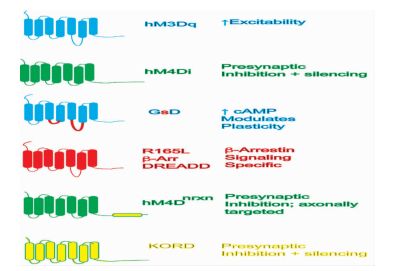
|
图 3 目前可以命名应用的DREADDs和激活下游的神经元效应 |
光遗传学技术让研究人员可以更透彻的来研究神经电路元件的功能,并在鉴定抑郁症等神经精神疾病中失调的新型神经通路中起到了重要作用。由于在各种不同的神经元的异质群体诸如纹状体末端(BNST)的床核以及它们大量投影的区域中,对研究神经电路如何在刺激之后变化受到限制。使用光遗传学工具,在体内我们能够选择性地隔离有助于这些疾病和扰乱这些疾病的不同神经回路。
3.1 通过光遗传学技术明确与抑郁症相关的神经元类型与抑郁症相关的神经元种类众多,通过光遗传技术已经明确:脑腹侧被盖区(ventral tegmentalarea, VTA)内多巴胺能神经元与抑郁行为有关[21], 同时有研究表明VTA内谷氨酸能神经元和γ-氨基丁酸能神经元等非多巴胺能神经元也可能对抑郁行为有调节作用[22]。用光遗传学方法发现伏核(nucleus aeeumbens, NAe)内与抑郁相关的神经元:D1型中型多棘神经元(D1 hype medium spiny neurons, D1-MSNs)、D2型中型多棘神经元(D2 hype medium spiny neurons, D2-MSNs)和胆碱能中间神经元。众所周知,中缝核(dorsal raphe nucleus, DRN)内的5-羟色胺能神经元与抑郁行为密切相关。近期应用遗传学技术发现,DRN中γ-氰基丁酸能神经元也与抑郁行为的产生有关[23]。
3.2 光遗传学技术揭示抑郁症相关神经通路通过研究发现与抑郁症相关的神经通路主要有以下几条。VTA-VAc多巴胺神经通路,此通路激活导致小鼠社交逃避行为和糖水偏爱减弱行为[24]。VTA-内侧前额叶皮质(medial prefrontal cortex, mPFC)多巴胺神经通路:此通路兴奋,使小鼠出现抗抑郁效应,抑制社交逃避。mPFC-DRN神经通路:光遗传学技术表明该通路兴奋时,小鼠表现抑郁, 此通路抑制时,小鼠表现抗抑郁。终纹床核(bed nucleus of the stria terminalis, BNST)-VTA神经通路对奖赏行为和探索行为有影响。BNST与处理压力以及病理性焦虑状态有关,此外,BNST已经作为药物调节应激诱导的关键结构。光刺激BNST区域产生焦虑样行为,一系列实验中,发现光刺激BNST-VTA的谷氨酸导致厌食和焦虑样行为,而光刺激BNST-VTA终端促进奖励相关行为和缓冲应激产生的焦虑[25]。这两个结果研究表明,BNST在压力,焦虑和奖励方面的影响比之前的研究更复杂。
4 化学遗传学技术在抑郁症研究中的应用中缝背核是中枢5-羟色胺(5-HT)能神经元的主要聚集部位之一, 目前大部分抗抑郁药是5-HT类药物,但对于精确的治疗机制和不利影响尚不清楚, 并且选择性操纵DRN血清素能神经元已被证明是困难的。采用hM3Dq DREADD与Gq信号通路相耦合,并作为神经元激活的信号通路,远程控制DRN血清素能神经元数周,研究发现短期和长期激活的DRN 5-HT神经元诱发不同的行为, 同时,使用新开发的技术将这些行为变化可以与全脑代谢活动的改变联系起来。研究数据证明DRN血清素能神经元在调节抗抑郁样活动中发挥关键作用,与昼夜节律调节行为的变化有关。发现5-HT可以通过差异调节相同的神经元诱导焦虑以及抗抑郁样反应。
总之,DRN血清素能神经元的激活足以展现以全身5-HT系统为目标的抗抑郁药的作用。另外,选择性DRN血清素能激活的影响,潜在地描绘了与抑郁症有关的区域电路。除了对血清素能调节的研究之外,研究结果突出了基于DREADDs的化学遗传策略的功能,有助于了解研究复杂神经通路[26]。
慢性脑疾病(包括重度抑郁和正常衰老)报告表示生长抑素(SST)的表达减少。SST是γ-氨基丁酸(GABA)神经元的信号传导神经肽的标志物,其特异性抑制锥体神经元树突。GABA神经元具有多种多样的分子,结构,和电生理特征,其生物成分变化会激发或抑制细胞的兴奋性,与癫痫和神经精神障碍(如:精神分裂症和重度抑郁障碍)有关。使用两种互补的病毒载体策略来检查SST急性与慢性抑制神经元对成年小鼠行为情绪的影响。Amelie Soumi2er等人采用DREADD-hM4Di方法注射CNO,发现SST急性抑制神经元增加焦虑状态,而慢性抑制平稳情绪,减少焦虑[27]。
5 光遗传学和化学遗传学在抑郁症研究中的联合应用光遗传学和化学遗传学方法通过检测细胞信号传导和电活动来控制神经元和机体。作为互补技术,光遗传学和化学遗传学已经解构了负责行为的神经元代码,发挥了强大效用。但作为新兴技术两者有各自的优缺点, 在抑郁症中的治疗中有不同的侧重点。
目前的光遗传学战略可以用于检查从突触到行为的神经回路功能。光遗传学技术最大的特点是,能给清醒动物施加光刺激,改变目标神经元的功能,并能实时记录动物体内神经元放电。最新的光遗传学装置能最低程度地损害大脑,不限制主体自由移动性和精确的靶向控制[28]。光遗传技术可以精确的对单一神经元进行定位,对时间达到微秒的控制,减少了对抑郁症治疗的副作用。重要的是,光遗传学技术可以用于长期的行为操纵,这对于鉴定涉及慢性疾病的神经回路是至关重要的。
光遗传学需要专门的设备并且在技术上具有挑战性,限制其广泛使用,DREADDs操作简单易于控制,可以长时间内运作,但是对比于光遗传技术控制不够精确。在分散的结构中DREADDs可以以高度的空间分辨率将基因引入靶向的细胞群体,但是另一方面,由于CNO的行动方式几乎不受控制,DREADDs技术时间分辨率低,不能成为实时监控神经元活动的有用工具。然而,化学遗传学工具允许调制更大的脑区,这通过光遗传途径照射是不可行的[29]。
总之,化学遗传学和光遗传学工具在它们的可行性和时空方面具有不同解析度。每个工具都有一个潜在的优势和限制,需要根据具体实验设计来选定[30]。光遗传学和化学遗传学已经彻底改变了研究神经元电路的传统思路,具有解剖特定GPCR信号通路的巨大潜力作用。这两种技术可以进一步表明行为和疾病状态的突触前和突触后信号,了解神经药物的作用机制[31]。两种技术可以互相补充,来研究GPCR传导特异性[32]。
6 展望光遗传学和化学遗传学已经彻底改变了研究神经元的方式,对于研究GPCR信号通路具有巨大的潜力,使用单个工具或多个工具能够实现信号通路的双向神经调节,控制神经元。基于KOR的一种新的化学遗传工具,称之为KORD(k-opioid DREADD)的开发,可以单独使用或与其他化学遗传工具一起使用,从而促进神经回路和行为的多重解剖。DREADDs可以靶向GPCR的药物的开发,DREADDs将为新一代GPCR药物提供独特的靶向治疗,并可以进行药理研究。使用这些新型工具有助于了解神经药物作用机制,有助于发现新药物。但就目前研究来说,光遗传学和化学遗传学还停留在初步研究阶段,动物实验主要以大鼠为主,而就大脑回路分析,老鼠与人类有巨大区别。并且病毒转导的副作用还未得到验证和攻克。光遗传学和化学遗传学对于应用于人类疾病还有很长的路要走。
但总体来讲随着光遗传学技术和化学遗传学技术的发展,对抑郁症的研究越来越透彻,更加明确抑郁症的发病机制和生理病理状况,对抑郁症的治疗带来新的思路和方法,有希望实现抑郁症患者的痊愈。
| [1] | Fayazi M, Hasani J. Structural relations between brain-behavioral systems, social anxiety, depression and internet addiction:With regard to revised Reinforcement Sensitivity Theory (r-RST)[J]. Computers in Human Behavior, 2017, 72: 441–448. DOI:10.1016/j.chb.2017.02.068 |
| [2] | Smith K. Mental health:a world of depression[J]. Nature, 2014, 515(7526): 180–181. DOI:10.1038/515180a |
| [3] | 牛晨旭, 张海林. 利用光遗传学研究抑郁行为神经机制的新进展[J]. 生理科学进展, 2015, 46(5): 387–390. |
| [4] | Vann KT, Xiong ZG. Optogenetics for neurodegenerative diseases[J]. Int J Physiol Pathophysiol Pharmacol, 2016, 8(1): 1–8. |
| [5] | Hallett RA, Zimmerman SP, Yumerefendi H, et al. Correlating in vitro and in vivo activities of light-inducible dimers:a cellular optogenetics guide[J]. ACS Synth Biol, 2016, 5(1): 53–64. DOI:10.1021/acssynbio.5b00119 |
| [6] | Stamatakis A M, Stuber G D. Optogenetic strategies to dissect the neural circuits that underlie reward and addiction[J]. Cold Spring Harb Perspect Med, 2012, 2(11): 1–7. DOI:10.1101/cshperspect.a011924 |
| [7] | Tye KM, Deisseroth K. Optogenetic investigation of neural circuits underlying brain disease in animal models[J]. Nat Rev Neurosci, 2012, 13(4): 251–266. DOI:10.1038/nrn3171 |
| [8] | Nussinovitch U, Gepstein L. Optogenetics for in vivo cardiac pacing and resynchronization therapies[J]. Nat Biotechnol, 2015, 33(7): 750–754. DOI:10.1038/nbt.3268 |
| [9] | Steinberg EE, Christoffel DJ, Deisseroth K, et al. Illuminating circuitry relevant to psychiatric disorders with optogenetics[J]. Curr Opin Neurobiol, 2015, 30: 9–16. DOI:10.1016/j.conb.2014.08.004 |
| [10] | Montgomery KL, Yeh AJ, Ho JS, et al. Wirelessly powered, fully internal optogenetics for brain, spinal and peripheral circuits in mice[J]. Nat Methods, 2015, 12(10): 969–974. DOI:10.1038/nmeth.3536 |
| [11] | Siuda ER, McCall JG, Al-Hasani R, et al. Optodynamic simulation of β-adrenergic receptor signalling[J]. Nat Commun, 2015, 6: 8480. DOI:10.1038/ncomms9480 |
| [12] | 刘自强, 王晞. 光遗传学技术与应用[J]. 医学综述, 2016, 22(14): 2720–2724. DOI:10.3969/j.issn.1006-2084.2016.14.005 |
| [13] | 陈宜张. 光遗传学研究[J]. 科学(上海), 2014, 66(4): 21–26. DOI:10.3969/j.issn.0368-6396.2014.04.006 |
| [14] | Yizhar O, Fenno LE, Davidson TJ, et al. Optogenetics in neural systems[J]. Neuron, 2011, 71(1): 9–34. DOI:10.1016/j.neuron.2011.06.004 |
| [15] | Urban DJ, Roth BL. DREADDs (designer receptors exclusively activated by designer drugs):chemogenetic tools with therapeutic utility[J]. Annu Rev Pharmacol Toxicol, 2015, 55: 399–417. DOI:10.1146/annurev-pharmtox-010814-124803 |
| [16] | Zhu H, Aryal DK, Olsen RH, et al. Cre-dependent DREADD (Designer Receptors Exclusively Activated by Designer Drugs) mice[J]. Genesis, 2016, 54(8): 439–446. DOI:10.1002/dvg.22949 |
| [17] | Dobrzanski G, Kossut M. Application of the DREADD technique in biomedical brain research[J]. Pharmacol Rep, 2017, 69(2): 213–221. DOI:10.1016/j.pharep.2016.10.015 |
| [18] | Vardy E, Robinson JE, Li C, et al. A New DREADD facilitates the multiplexed chemogenetic interrogation of behavior[J]. Neuron, 2015, 86(4): 936–946. DOI:10.1016/j.neuron.2015.03.065 |
| [19] | Kruse AC, Kobilka BK, Gautam D, et al. Muscarinic acetylcholine receptors:novel opportunities for drug development[J]. Nat Rev Drug Discov, 2014, 13(7): 549–560. DOI:10.1038/nrd4295 |
| [20] | Zhu H, Roth BL.DREADD:a chemogenetic GPCR signaling platform[J].Int J Neuropsychopharmacol, 2014, 18(1):pyu007-pyu007.DOI:10.1093/ijnp/pyu007. |
| [21] | Friedman AK, Walsh JJ, Juarez B, et al. Enhancing depression mechanisms in midbrain dopamine neurons achieves homeostatic resilience[J]. Science, 2014, 344(6181): 313–319. DOI:10.1126/science.1249240 |
| [22] | Jennings JH, Sparta DR, Stamatakis AM, et al. Distinct extended amygdala circuits for divergent motivational states[J]. Nature, 2013, 496(7444): 224–228. DOI:10.1038/nature12041 |
| [23] | Challis C, Boulden J, Veerakumar A, et al. Raphe GABAergic neurons mediate the acquisition of avoidance after social defeat[J]. J Neurosci, 2013, 33(35): 13978–13988. DOI:10.1523/JNEUROSCI.2383-13.2013 |
| [24] | Chaudhury D, Walsh JJ, Friedman AK, et al. Rapid regulation of depression-related behaviours by control of midbrain dopamine neurons[J]. Nature, 2013, 493(7433): 532–536. DOI:10.1038/nature11713 |
| [25] | Sparta DR, Jennings JH, Ung RL, et al. Optogenetic strategies to investigate neural circuitry engaged by stress[J]. Behav Brain Res, 2013, 255: 19–25. DOI:10.1016/j.bbr.2013.05.007 |
| [26] | Urban DJ, Zhu H, Marcinkiewcz CA, et al. Elucidation of the behavioral program and neuronal network encoded by dorsal raphe serotonergic neurons[J]. Neuropsychopharmacology, 2016, 41(5): 1404–1415. DOI:10.1038/npp.2015.293 |
| [27] | Soumier A, Sibille E. Opposing effects of acute versus chronic blockade of frontal cortex somatostatin-positive inhibitory neurons on behavioral emotionality in mice[J]. Neuropsychopharmacology, 2014, 39(9): 2252–2262. DOI:10.1038/npp.2014.76 |
| [28] | Jeong JW, McCall JG, Shin G, et al. Wireless optofluidic systems for programmable in vivo pharmacology and optogenetics[J]. Cell, 2015, 162(3): 662–674. DOI:10.1016/j.cell.2015.06.058 |
| [29] | Spangler SM, Bruchas MR. Optogenetic approaches for dissecting neuromodulation and GPCR signaling in neural circuits[J]. Curr Opin Pharmacol, 2017, 32: 56–70. DOI:10.1016/j.coph.2016.11.001 |
| [30] | Robinson S, Todd TP, Pasternak AR, et al. Chemogenetic silencing of neurons in retrosplenial cortex disrupts sensory preconditioning[J]. J Neurosci, 2014, 34(33): 10982–10988. DOI:10.1523/JNEUROSCI.1349-14.2014 |
| [31] | Spangler SM, Bruchas MR. Optogenetic approaches for dissecting neuromodulation and GPCR signaling in neural circuits[J]. Curr Opin Pharmacol, 2017, 32: 56–70. DOI:10.1016/j.coph.2016.11.001 |
| [32] | Siuda ER, Al-Hasani R, McCall JG, et al. Chemogenetic and optogenetic activation of Gαs signaling in the basolateral amygdala induces acute and social anxiety-like states[J]. Neuropsychopharmacology, 2016, 41(8): 2011–2023. DOI:10.1038/npp.2015.371 |



