点阵图预期(DPX)任务在近年来被大力推荐用于精神分裂症工作记忆障碍的评定工具[1-2],但是作为一种改良版的AX-CPT任务(Go/NoGo范式之一),DPX任务也可以用来评价反应抑制能力。在评价不同能力时,DPX任务使用了不同的评价指标[3]。我们在既往的一项针对DPX任务的行为水平研究中发现精神分裂症风险基因NOS1多态性rs3782206与反应抑制能力相关而与工作记忆能力并不相关。大量事件相关电位(event related potential,ERP)研究证实,在Go/NoGo实验范式中,NoGo刺激后大约200~300ms内前额叶产生的N2成分相对于Go刺激有更大的负向波幅,该现象被称为NoGo-N2效应[4]。通常认为该效应可以反映反应抑制能力中的冲突监控过程[5-6]。因此,我们希望通过本研究继续考察NOS1基因rs3782206是否作用于DPX任务中的NoGo-N2效应。
1 对象和方法 1.1 对象研究对象为2015年5月至2015年12月间招募的140名健康志愿者。入组标准:通过专业的精神科医师进行非结构化访谈排除精神病史和精神病家族史;年龄18~45岁;右利手;汉族;经矫正后视力正常。由被试签署知情同意书,本研究已获得北京师范大学伦理委员会的批准。其中,8名被试由于过高的错误率被剔除。在最终进入统计的132例被试中,男性105例,女性27例;平均年龄(26.7±5.0) 岁;平均受教育年限(12.3±2.7) 年;平均智商111.1±11.3。
1.2 方法 1.2.1 刺激材料和实验范式实验采用DPX任务[1],任务流程及刺激条件见图 1。DPX任务采用双刺激(线索刺激和探测刺激)任务范式,但与经典AX-CPT范式不同的是,DPX任务的刺激材料是12种不同的盲文点阵图形,其中线索刺激分为靶线索刺激A(由一种点阵图形构成)和非靶线索刺激B(由5种点阵图形构成),探测刺激分为靶探测刺激X(由一种点阵图形构成)和非靶探测刺激Y(由5种点阵图形构成)。被试需要对靶线索刺激A后出现的靶探测刺激X(即AX型刺激)做靶反应;而对其他情况(即AY、BX、BY型刺激)做非靶反应。

|
图 1 DPX任务流程图 |
实验任务流程如下:首先呈现持续时间为500ms的注视点;接着呈现线索刺激,持续时间为1000ms;随后,经过2000ms的空白间隔后,呈现探测刺激,持续时间为500ms;最后呈现空白间隔,随机持续时间1600~1650ms。探测刺激呈现后,被试就可以进行反应了。共包括240个试验,分为2个组块,每组块各包含120个试验。每个组块中AX、AY、BX、BY实验条件呈现次数分别为:84,15,15和6,相应占比分别为70%, 12.5%, 12.5%和5%。
反应抑制能力通常使用AY错误率(EAY)来评定[7],而工作记忆能力则通常使用BX错误率与AY错误率间的差异(EBX-AY)来评定[3]。
1.2.2 ERP数据采集和处理在被试进行任务的同时采集脑电图(EEG)数据,并同步记录行为学数据。采用BrainProduct(Gilching, German)的ERP系统和放大器及国际10-20标准系统64导的脑电帽记录EEG。采样滤波带通为0.01~100Hz,采样频率为500Hz,头皮与电极间阻抗<5kΩ。参考电极置于右乳突,接地电极置于前额正中,垂直眼动(VEOG)置于右眼眶的上方和下方,水平眼动(HEOG)置于左右外眦外侧。在采集过程中, 受试者坐在安静封闭、电屏蔽的记录室内,面对显示器,完成任务。
使用BrainVision Analysis软件对记录的EEG数据进行离线分析。EEG以全脑平均电极作为重新参照。预处理包括2Hz~12Hz范围的滤波(为防止N2成分被P3成分吸收)[8]。截取EEG片段分析视窗:探测刺激呈现前200ms(基线),至呈现后2000ms。以线索刺激前200ms脑电波幅的平均值作为基线。充分排除眼电(VEOG、HEOG)及其他伪迹(肌肉紧张、飘移等,波幅大于± 80μV者)等干扰。
对反应正确的EEG进行分类叠加,得到AX和AY两种实验条件分别的ERP数据。本研究只关注探测刺激阶段的N2成分,时间窗选取探测刺激呈现后250~320ms,根据脑电地形图,我们选择FCz电极进行分析。我们首先分别计算AY条件(N2AY)与AX条件(N2AX)分别的N2波,然后计算他们之间的差异波(N2AY-AX,用N2AY减去N2AX)。由于N2是负波,因此N2AY和N2AX波幅数值越大(越正)代表其相应N2波越小。由于AY条件诱发的N2波比AX条件诱发的N2波更大(更负),因此N2AY-AX波幅数值越大代表两个条件下的N2波差异越小。
1.2.3 基因分型以标准方法提取出全基因组DNA。使用Taqman allele-specific探针以及7900HT Fast实时PCR系统(Applied Biosystems,Foster City,CA,USA)进行rs3782206(C/T)的基因分型实验。分型成功率为100%,对50%样本进行重复测试确定分型正确率为100%。最终纳入分析的被试中,TT基因型10名;TC基因型51名;CC基因型71名。由于TT基因型被试人数偏少,我们将TT基因型和TC基因型合并为风险等位基因携带者组(N=61),而将纯合子CC基因型作为风险等位基因非携带者组(N=71)。
1.3 统计学方法使用PLINK软件对基因型进行Hardy-Weinberg平衡吻合度检验。其余所有统计均采用SPSS20.0进行。在对基因型组间一般人口学因素的比较中,采用独立样本t检验或χ2检验对其分析。
采用偏相关分析来验证以NoGo-N2效应作为反应抑制能力电生理指标的正确性。控制年龄、性别和EBX-AY因素后,检测行为水平测量指标EAY与探测阶段差异波N2AY-AX波幅的相关性。
采用协方差分析检测N2成分与rs3782206基因型之间的相关性。在这个分析中,基因型(TT/TC,CC)为自变量,年龄和性别为协变量,N2AY-AX为因变量。
2 结果 2.1 人口学因素比较样本内总体被试基因型符合Hardy-Weinberg平衡检验(P>0.05)。基因型组间的年龄、性别、受教育程度和智商等各人口学因素的分布均无显著性差异(P>0.05)(见表 1)。
| 表 1 rs3782206基因型组间人口学因素的比较 |
偏相关分析结果显示,在控制了协变量年龄、性别和工作记忆能力(EBX-AY)后,差异波N2AY-AX的波幅与EAY偏相关系数r=0.21(P<0.05)(图 2),即AY条件和AX条件间N2波幅差异越大(N2AY-AX越小),反应抑制能力越好(EAY越小)。
|
图 2 EAY与差异波N2AY-AX波幅的相关性 |
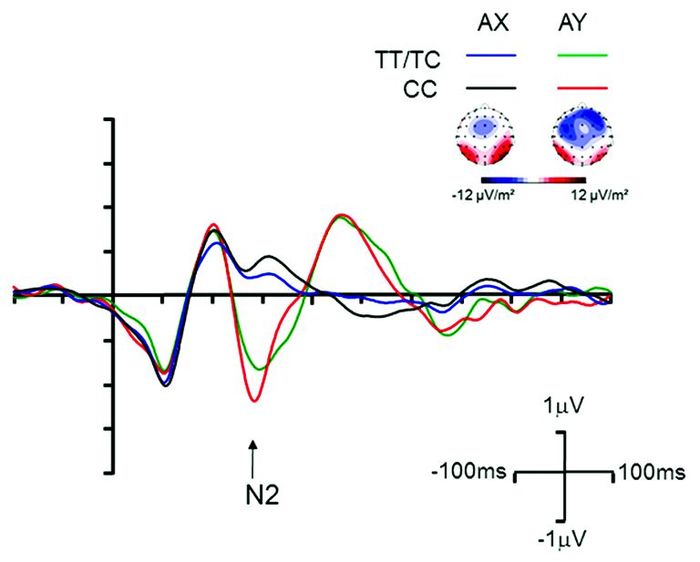
两组间探测刺激阶段的差异波N2AY-AX波幅存在显著差异(F=4.73;P<0.05)。协方差事后检验表明,携带风险等位基因者组的差异波N2AY-AX的波幅显著大于不携带风险等位基因者组,即携带风险等位基因者组在AY和AX两种不同实验条件下的N2成分差异更小。见图 3。

|
图 3 不同基因N2波形图 |
本研究基于课题组之前的研究发现,即精神分裂症风险基因多态性rs3782206与DPX任务EAY显著相关,进一步分析了该相关性的脑机制。结果发现rs3782206与NoGo-N2效应显著相关。提示rs3782206风险等位基因通过反应抑制能力缺陷而增加精神分裂症发病风险。
在DPX任务中,由于AX实验条件占比高达70%,而AY实验条件只占比12.5%,即大多数靶线索刺激后面出现的都是靶探测刺激,因此若被试识别出靶线索刺激A并将之成功保留在工作记忆中,则会产生强烈的要进行靶反应的预期和冲动。如此一来,当靶线索刺激刺激后的探测刺激不是X而是Y时,被试需要抑制住这种预期和冲动,否则就容易产生错误的按键反应,造成EAY显著升高[9]。这也是既往研究经常使用EAY作为反应抑制功能行为学评定指标的原因。
NoGo-N2效应主要出现在Go/NoGo实验范式中,是NoGo实验条件相对于Go实验条件产生更大的N2波。既往研究提示NoGo-N2效应对反应抑制功能的评定具有高度灵敏度和客观性[5-6]。DPX任务的AX和AY实验条件恰好满足Go/NoGo实验范式的要求。AX实验条件对应Go实验条件,而AY实验条件对应NoGo实验条件。本研究中,由图 2所示波形图可以看到明显的NoGo-N2效应。无论在何种基因型中,AY实验条件都可以诱发出比AX实验条件更大的N2。接下来,我们使用差异波N2AY-AX刻画NoGo-N2效应,并发现N2AY-AX波幅与EAY显著相关,提示AY和AX两个实验条件间N2的波幅差异越大,则反应抑制能力越强。这一发现与既往其他课题组研究结果是一致的,例如Falkenstein等[10]发现在Go/NoGo任务中NoGo错误率越低,NoGo-N2效应越明显。因此,N2成分可以表征反应抑制功能。综上,我们使用探测刺激后面的N2作为脑电生理指标来研究rs3782206与反应抑制能力之间的关系是可行的。
本研究使用协方差分析发现rs3782206实验条件的交互作用显著,即风险等位基因携带者AY与AX条件下N2的差异变小。这为我们在行为水平研究中发现的风险等位基因携带者EAY升高提供了电生理证据,即rs3782206与反应抑制能力相关。具体来说,正是因为风险等位基因损害了反应抑制能力,使得风险等位基因携带者在AY实验条件下不能抑制住进行靶反应的冲动而做出了错误的反应。
基于本研究结果,我们可以解释课题组在既往发表的研究中的其他结果[11]。在既往的这项研究中,我们发现风险等位基因携带者N-BACK任务的错误率升高[12],stroop任务及ANT任务的冲突效应增大[13-14]。在对DPX任务的分析中,虽然发现风险等位基因导致EAY升高,但EBX-AY并无显著升高或降低。通过本研究结果,我们可以了解rs3782206可能通过作用于反应抑制能力而产生与上述行为水平评定指标的相关性。事实上,上述任务中均包含反应抑制能力的评价。在N-BACK任务中,被试需要克服当前刺激的影响,而对当前刺激之前的刺激进行反应。在stroop任务中,被试需要克服语言刺激对颜色刺激的干扰。在ANT这一flanker任务中,被试需要克服两侧干扰刺激的影响而对中间的靶刺激进行反应。
综上所述,本研究应用ERP技术,通过对N2成分的分析,发现NOS1基因rs3782206风险等位基因携带者NoGo-N2效应减弱。这为该风险基因与精神分裂症的相关性提供了脑机制方面的证据,从而帮助我们更好地理解风险基因多态性的易感机制。
| [1] | Barch DM, Berman MG, Engle R, et al. CNTRICS final task selection:working memory[J]. Schizophr Bull, 2009, 35(1): 136–152. DOI:10.1093/schbul/sbn153 |
| [2] | Carter CS, Minzenberg M, West R, et al. CNTRICS imaging biomarker selections:Executive control paradigms[J]. Schizophr Bull, 2012, 38(1): 34–42. DOI:10.1093/schbul/sbr114 |
| [3] | Henderson D, Poppe AB, Barch DM, et al. Optimization of a goal maintenance task for use in clinical applications[J]. Schizophr Bull, 2012, 38(1): 104–113. DOI:10.1093/schbul/sbr172 |
| [4] | 岳玲, 唐莺莹, 亢清, 等. 神经性厌食患者反应抑制功能事件相关电位的研究[J]. 临床精神医学杂志, 2016, 26(3): 151–154. |
| [5] | Bekker EM, Kenemans JL, Verbaten MN. Electrophysiological correlates of attention, inhibition, sensitivity and bias in a continuous performance task[J]. Clin Neurophysiol, 2004, 115(9): 2001–2013. DOI:10.1016/j.clinph.2004.04.008 |
| [6] | Smith JL, Johnstone SJ, Barry RJ. Effects of pre-stimulus processing on subsequent events in a warned Go/NoGo paradigm:response preparation, execution and inhibition[J]. Int J Psychophysiol, 2006, 61(2): 121–133. DOI:10.1016/j.ijpsycho.2005.07.013 |
| [7] | Hogan M, Kiefer M, Kubesch S, et al. The interactive effects of physical fitness and acute aerobic exercise on electrophysiological coherence and cognitive performance in adolescents[J]. Exp Brain Res, 2013, 229(1): 85–96. DOI:10.1007/s00221-013-3595-0 |
| [8] | Donkers FC, van Boxtel GJ. The N2 in go/no-go tasks reflects conflict monitoring not response inhibition[J]. Brain Cogn, 2004, 56(2): 165–176. DOI:10.1016/j.bandc.2004.04.005 |
| [9] | 陈安涛, 宋爽. 酒精对认知控制方式的影响[J]. 辽宁师范大学学报(社会科学版), 2016, 39(2): 45–52. DOI:10.16216/j.cnki.1sxbwk.201602045 |
| [10] | Falkenstein M, Hoormann J, Hohnsbein J. ERP components in Go/Nogo tasks and their relation to inhibition[J]. Acta Psychol (Amst), 1999, 101(2-3): 267–291. DOI:10.1016/s0001-6918(99)00008-6 |
| [11] | Zhang Z, Chen X, Yu P, et al. Evidence for the contribution of NOS1 gene polymorphism (rs3782206) to prefrontal function in schizophrenia patients and healthy controls[J]. Neuropsychopharmacology, 2015, 40(6): 1383–1394. DOI:10.1038/npp.2014.323 |
| [12] | Kopf J, Schecklmann M, Hahn T, et al. NOS1 ex1f-VNTR polymorphism influences prefrontal brain oxygenation during a working memory task[J]. Neuroimage, 2011, 57(4): 1617–1623. DOI:10.1016/j.neuroimage.2011.05.034 |
| [13] | Fan J, Flombaum JI, McCandliss BD, et al. Cognitive and brain consequences of conflict[J]. Neuroimage, 2003, 18(1): 42–57. DOI:10.1006/nimg.2002.1319 |
| [14] | Kopf J, Schecklmann M, Hahn T, et al. NOS1 ex1f-VNTR polymorphism affects prefrontal oxygenation during response inhibition tasks[J]. Hum Brain Mapp, 2012, 33(11): 2561–2571. DOI:10.1002/hbm.21382 |



