2. 卫生部精神卫生学重点实验室暨国家精神心理疾病临床医学研究中心(北京大学), 北京 100191;
3. 赛诺菲(中国)投资有限公司上海分公司, 上海 200040;
4. 蓬莱市人民医院, 蓬莱 265600
2. Key Laboratory of Mental Health, Ministry of Health & National Clinical Research Center for Mental Disorders(Peking University), Beijing 100191, China;
3. Sanofi Company, Shanghai 20040, China;
4. Penglai People's Hospital, Penglai 265600, China
精神分裂症是一种常见的多基因复杂疾病。其病因及发病机制至今尚未明确,目前对于精神分裂症谷氨酸假说的分子生物学研究主要涉及谷氨酸受体及相关酶、转运体、受体结合蛋白等基因多态性及mRNA表达研究。其中N-甲基-D-天氡氨酸离子能谷氨酸受体2B (glutamate ionotropic receptor NMDA type subunit 2B, GRIN2B)参与精神分裂症及认知功能的重要作用不容忽视。
GRIN2B基因位于染色体12p12区域,编码NMDA受体2B蛋白,是精神分裂症和双相情感障碍的易感基因之一[1-4]。Jablensky等发现GRIN2B基因的单核苷酸多态性(single nucleotide polymorphism, SNP)与精神分裂症部分内表型如记忆功能损害、注意功能等关联[5-6]。Arnold等研究发现GRIN2B基因的单核苷酸位点多态性(single nucleotide polymorphism, SNP)rs1805247与儿童期强迫症患者大脑前额叶皮层、扣带回、眶额叶的灰质体积关联显著[7];且独立成分分析发现GRIN2B基因多态性可能影响被试大脑结构和功能[8]。
本研究拟采用病例对照设计,探究rs1805247位点多态性对于精神分裂症患者的大脑结构和静息态功能磁共振成像表型的作用,希望能够发现GRIN2B基因rs1805247位点多态性与精神分裂症影像学表型的关联证据。
1 资料与方法 1.1 一般资料本研究纳入97例精神分裂症患者、99例健康正常对照者,患者为住院或门诊患者,依据美国精神疾病诊断与统计手册第四版(DSM-Ⅳ)精神分裂症的诊断标准,由两名以上的精神科医师(其中至少一名是主治医师)独立诊断。正常对照者则通过社区公开招募入组,经非结构式临床访谈排除精神疾病,且家族中无精神疾病及自杀者,个体间无血缘关系。本研究获得了北京大学第六医院伦理委员会的审核批准,所有研究对象均详细了解并签署了知情同意书。
1.1.1 病例组入组标准:18~45岁,男女不限;汉族;右利手;采用精神障碍诊断与统计手册第4版(DSM-Ⅳ)结构式临床访谈(SCID)手册,符合轴Ⅰ关于精神分裂症的临床诊断标准;患者本人及法定监护人签署知情同意书。排除标准:患有明确颅脑外伤或卒中史;或者有严重的躯体疾病;符合DSM-Ⅳ轴Ⅰ诊断标准的分裂症情感性障碍、心境障碍、精神发育迟滞、阿尔茨海默病、物质滥用所致精神障碍等;磁共振扫描禁忌证。
1.1.2 正常对照组入组标准:18~45岁,男女不限;汉族;右利手。排除标准:明确躯体疾病病史;受试者或一级亲属符合DSM-Ⅳ轴Ⅰ诊断标准的任何精神障碍;磁共振扫描禁忌证。
1.2 方法 1.2.1 遗传检测采集被试外周静脉血约5ml,置于EDTA抗凝管中;采用Qiagen全血基因组提取试剂盒提取DNA,-80℃冰箱保存备用。
采用DNA测序方法进行基因分型检测。PCR反应体系:DNA模板10ng,上下游引物(10μM)各0.5μM,dNTP(10mM) 1mM,Taq聚合酶5U,聚合酶缓冲液(10) 10倍稀释,ddH2O补足25μl反应体积。PCR扩增反应条件为:94 ℃预变性5min,94 ℃变性30s,58 ℃退火30s,72℃延伸1min,共35个循环,最后72 ℃后延伸10min。取20μl的PCR产物经美国应用生物系统公司Applied Biosystems (ABI) AmpliTaq DNA聚合酶荧光标记测序试剂盒(Big Dye Terminator Cycle Sequencing Ready Reaction Kit)纯化,内引物扩增,采用ABI PRISM 377-96 DNA测序仪检测,采用Chromas软件读取基因型。
1.2.2 脑影像学数据的采集磁共振成像扫描在影像中心Siemens Trio 3.0 T磁共振成像扫描仪上完成。1) 高分辨率3D T1加权序列扫描参数:重复时间(TR)=2350ms,回波时间(TE)=3.44ms,翻转角=7°,矩阵=256×256,视野=220mm×220mm,层厚=1mm,体素=1.0mm×1.0mm×1.5mm,192层。2) 静息状态下功能磁共振扫描参数:使用回波平面成像(EPI)序列采集功能相图像,重复时间(TR)=2s,回波时间(TE)=30ms,翻转角=90°,矩阵=64×64,视野=220mm×220mm,层厚/层间距=1mm/0.8mm,体素=3.438mm×3.438mm×4.800mm,33层,240个时间点。
1.2.3 脑影像学数据分析T1序列图像的处理:所有被试T1序列的图像均在Matlab 2012a工具平台上运用SPM8工具包采用VBM(http://dbm.neuro.uni-jena.de/vbm8/)提供的算法对全脑数据进行预处理。静息态扫描序列图像数据处理在Matlab2012a工具平台上运用DPARSF和REST工具包进行处理。
精息态低频振幅(amplitude of low-frequency fluctuation, ALFF)值计算:使用DPARSF工具计算出逐个体素在0.01~0.1Hz的平均振幅值,然后除以基于全脑平均的ALFF值即mALFF值,最后获得每个体素的标准化的ALFF值。
1.3 统计学方法采用独立样本t检验或χ2检验分析组间一般资料差异。采用独立样本t检验分析组间的脑灰质体积和ALFF值差异,并对结果进行假阳性发现率校正(False Discovery Rate,FDR,corrected P<0.05)。采用SPM 8软件全因素统计检验模型探索基因型与疾病风险间的交互作用,同时纳入年龄和性别作为协变量,进而对差异结果进行FDR校正。
2 结果 2.1 一般人口学资料经过图像数据预处理,排除头动幅度大于3°及基因型检测不成功的24例被试,共73例病例、99名正常对照进入分析。两组间一般资料差异无统计学意义(P>0.05)。见表 1。
| 表 1 一般人口学资料比较 |
两组间GRIN2B基因rs1805247位点基因型频率与等位基因频率差异均无统计学意义,提示该位点在本研究小样本中与精神分裂症无关联。见表 2。
| 表 2 GRIN2B基因rs1805247位点与精神分裂症的关联分析 |
对照组GRIN2B基因rs1805247位点G等位基因携带者较之AA纯合子携带者,右侧扣带回、额叶、顶叶下回、中央旁小叶等区域灰质体积增加,FDR校正后扣带回差异仍具显著性(q<0.001)。病例组患者G等位基因携带者较之AA纯合子携带者,颞上回、额内侧回、前扣带、旁后带回、额上回及顶叶等区域灰质体积增加(P<0.001),经FDR校正后差异不显著。全因素统计模型分析发现,rs1805247位点多态性主效应位于顶叶下回及扣带回(P<0.001),但FDR校正后不显著。基因型与疾病的交互效应体现在枕叶、楔叶、距状叶、扣带回和内侧额上回(P<0.001)。见图 1。
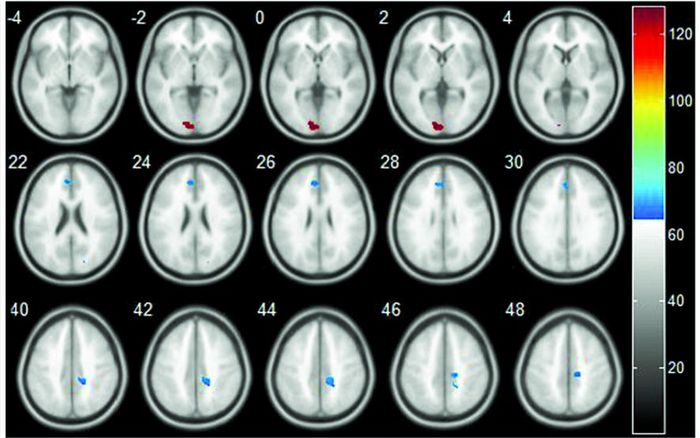
|
图 1 GRIN2B基因rs1805247基因型与精神分裂症患病风险对脑灰质体积的交互作用 |
对照组GRIN2B基因rs1805247位点与静息态ALFF的关联分析无统计学意义(P>0.05)。病例组GRIN2B rs1805247位点G等位基因位携带者较之AA纯合子携带者,海马旁回、边缘叶的ALFF活性增强(P<0.001),FDR校正后,海马旁回活性减弱有显著性(q<0.05)。全因素统计模型分析发现,GRIN2B基因rs1805247位点对静息态ALFF值的主效应位于颞上回(P<0.001),FDR校正后,在颞上回的主效应仍有显著性(P<0.05) (图 2)。基因型与疾病的交互效用未有统计学意义。
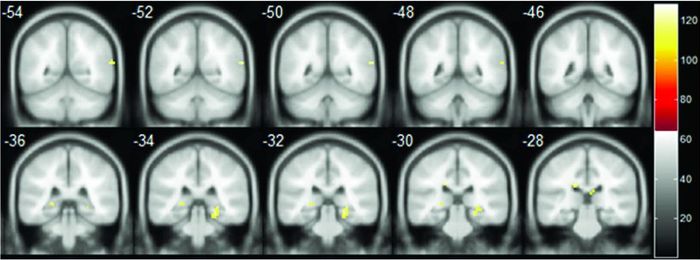
|
图 2 GRIN2B基因rs1805247位点与静息态ALFF的关联(P<0.05) |
精神分裂症是一种常见的复杂疾病,目前仍缺乏客观有效的生物学标记,影像遗传学研究有助于阐明其发病机制[9]。本研究基于既往研究线索,探索GRIN2B基因rs1805247多态性位点与精神分裂症脑灰质结构及静息状态ALFF功能的关联。
结果显示,正常对照组中GRIN2B基因rs1805247位点G等位基因携带者扣带回、额叶、顶叶下回、中央旁小叶等脑区灰质体积增加;精神分裂症病例组中G等位基因携带者颞上回、额内侧回、前扣带和旁扣带回、额上回及顶叶等脑区灰质体积增加。GRIN2B基因rs1805247位点的基因型主效应位于顶叶下回及扣带回(P<0.001);基因与疾病风险的交互作用位于枕叶、楔叶、距状叶、扣带回和内侧额上回(P<0.001)。
在静息态功能磁共振成像研究中,基于ALFF值[1]的统计分析发现,精神分裂症患者G等位基因携带者海马旁回的激活增强;基因型主效应位于颞上回(P<0.001);但基因与疾病风险交互作用对ALFF的影响无统计学意义。
考虑到人脑的扣带回主要与情感的产生和社会行为有关[10],GRIN2B rs1805247位点可能参与调节精神分裂症还则扣带回体积降低的病理调节机制。海马旁回的主要功能包括参与记忆的编码和回忆相关的神经机制调节,精神分裂症患者GRIN2B基因rs1805247位点G等位基因携带者呈现静息状态海马旁回激活增加,在一定程度上揭示了精神分裂症患者认知功能异常的神经病理学基础;颞上回是杏仁核和前额叶皮层的通路中的重要结构,主要参与社会认知功能形成[11],而精神分裂症患者颞上回活性降低,提示谷氨酸受体基因GRIN2B的rs1805247位点可能参与调节患者社会认知功能异常的病理机制。
总之,本研究采用影像遗传学研究技术发现,GRIN2B基因rs1805247多态性与精神分裂症影像学异常显著关联,G等位基因携带者大脑皮层如扣带回体积的增加和海马旁回功能激活增强。但样本量较小,仍需更大样本量的重复实验进行验证。
| [1] | Fallin MD, Lasseter VK, Avramopoulos D, et al. Bipolar Ⅰ disorder and schizophrenia:a 440-single-nucleotide polymorphism screen of 64 candidate genes among Ashkenazi Jewish case-parent trios[J]. Am J Hum Genet, 2005, 77(6): 918–936. DOI:10.1086/497703 |
| [2] | Guo Z, Niu W, Bi Y, et al. A study of single nucleotide polymorphisms of GRIN2B in schizophrenia from Chinese Han population[J]. Neurosci Lett, 2016, 630: 132–135. DOI:10.1016/j.neulet.2016.07.038 |
| [3] | Zhao Q, Che R, Zhang Z, et al. Positive association between GRIN2B gene and bipolar disorder in the Chinese Han Population[J]. Psychiatry Res, 2011, 185(1-2): 290–292. DOI:10.1016/j.psychres.2009.11.026 |
| [4] | Qin S, Zhao X, Pan Y, et al. An association study of the N-methyl-D-aspartate receptor NR1 subunit gene (GRIN1) and NR2B subunit gene (GRIN2B) in schizophrenia with universal DNA microarray[J]. Eur J Hum Genet, 2005, 13(7): 807–814. DOI:10.1038/sj.ejhg.5201418 |
| [5] | Jablensky A, Morar B, Wiltshire S, et al. Polymorphisms associated with normal memory variation also affect memory impairment in schizophrenia[J]. Genes Brain Behav, 2011, 10(4): 410–417. DOI:10.1111/j.1601-183X.2011.00679.x |
| [6] | Greenwood TA, Lazzeroni LC, Calkins ME, et al. Genetic assessment of additional endophenotypes from the Consortium on the Genetics of Schizophrenia Family Study[J]. Schizophr Res, 2016, 170(1): 30–40. DOI:10.1016/j.schres.2015.11.008 |
| [7] | Arnold PD, Macmaster FP, Hanna GL, et al. Glutamate system genes associated with ventral prefrontal and thalamic volume in pediatric obsessive-compulsive disorder[J]. Brain Imaging Behav, 2009, 3(1): 64–76. DOI:10.1007/s11682-008-9050-3 |
| [8] | Vergara VM, Ulloa A, Calhoun VD, et al. A three-way parallel ICA approach to analyze links among genetics, brain structure and brain function[J]. Neuroimage, 2014, 98: 386–394. DOI:10.1016/j.neuroimage.2014.04.060 |
| [9] | Erk S, Mohnke S, Ripke S, et al. Functional neuroimaging effects of recently discovered genetic risk loci for schizophrenia and polygenic risk profile in five RDoC subdomains[J]. Transl Psychiatry, 2017, 7(1): e997. DOI:10.1038/tp.2016.272 |
| [10] | Hadland KA, Rushworth MF, Gaffan D, et al. The effect of cingulate lesions on social behaviour and emotion[J]. Neuropsychologia, 2003, 41(8): 919–931. DOI:10.1016/s0028-3932(02)00325-1 |
| [11] | Bigler ED, Mortensen S, Neeley ES, et al. Superior temporal gyrus, language function, and autism[J]. Dev Neuropsychol, 2007, 31(2): 217–238. DOI:10.1080/87565640701190841 |



