2. 德国科隆大学医院神经内科, 德国
2. Department of Neurology, Cologne University, Germany
人类运动根据诱发运动的类型不同可以分为2类:一类是对环境做出反应,从而满足环境的需要。比如看见红灯就引发紧急刹车的运动。另一类是基于自发的意志做出反应,从而达到特定的目标。比如想喝水而拿起桌子上的茶杯。在第二种情况下,并没有外界刺激(stimulus)的诱发,运动的执行是基于内部自发的心理目的或者意志(intention),从而达到既定的预期的效果。根据运动诱发的不同,我们通常称第一种运动为刺激诱发运动(stimulus-based action),称第二种运动为自发运动(intention-based action或者voluntary action)[1-2]。
之前相关的行为和心理生理学研究表明控制两种不同运动的心理过程存在着功能上的分化。Astor-jack等[3]发现,与单纯刺激诱发运动条件下的反应时相比,自发运动转变为刺激诱发的运动需要的反应时显著增加。他们结果表明反应时的延长是由一个控制系统转变成另一个控制系统时产生,并且这两个控制系统分别属于不同的控制通路才会导致反应时的延长。大量脑成像研究表明,即使被试执行的运动任务完全一致,这两种不同的运动诱发条件分别由不同的神经解剖通路控制(图 1)。在自发运动中,额叶中间皮层运动网络(fronto-median motor network)对运动的诱发和准备起到了重要的作用,主要包括辅助运动皮层(SMA,pre-SMA),前扣带回皮层(ACC)[4-5]。这一网络系统被广泛地证明与运动的选择、抑制、时间控制有关。另外Muller区分了这一系统下不同的脑区分别控制自发运动的不同方面。比如他们证明了前辅助运动皮层主要是控制运动时间的关键脑区。而扣带区喙部(rostral cingulate zone,RCZ)主要参与运动的选择[5]。而在刺激诱发的运动中,前运动皮层腹侧和背侧部(ventral premotor cortex,PMv; dorsal premotor cortex, PMd),后顶叶皮层(parietal cortex)等组成的运动控制网络起到重要的作用[1, 6]。而不同的运动诱发系统对运动的不同阶段(比如运动准备和运动执行阶段)的影响以及神经机制我们还不是很清楚。

|
图 1 两种不同运动诱发模式控制下的神经通路 红色通路代表刺激诱发运动,绿色通路代表自发运动。 |
相比其他脑成像技术(fMRI,PET),脑电图描记技术(EEG)能提供很高的时间分辨率,所以能有效地区分不同运动阶段的神经活动。在EEG的研究中,大量的研究已经在自发的运动活动中发现了运动准备电位(readiness potential,RP),而在刺激诱发运动中并没有发现该准备电位[1, 7]。Waszak等[1]利用EEG技术比较了自发运动和刺激诱发运动的区别。在刺激诱发的运动条件中,他们发现了顶叶成分P3和额中叶的偏侧化运动准备电位。所以,利用EEG技术,能帮助我们更具体的分析在不同的运动阶段下,不同运动诱发系统对运动神经机制的影响。
根据前期的研究结果,在本研究中我们设计了两类简单的动指运动:自发的动指运动和刺激诱发的动指运动。我们假设在两类不同的运动中,运动系统皮层的脑电活动会有显著的不同。同时我们假设,不同的运动诱发模式对运动准备和运动执行阶段有不同的影响,这些影响会体现在运动系统的脑电神经活动上,从而影响运动的表现。
1 方法与被试 1.1 被试本研究有偿招募了21名健康的被试(10名女性,11名男性,年龄范围:22~35岁)。所有被试均为右利手。视力或矫正视力正常,没有任何精神以及神经疾病。实验前所有被试均签订了知情同意书。
1.2 实验设计 1.2.1 实验任务实验由3种不同的条件组成(如图 2):1) 自发运动条件(self-initiated condition);2) 刺激诱发运动条件(visually-cued condition):3) 单纯视觉刺激条件(vision-only condition)。每个试次的开始先呈现一个“+”, 然后呈现指导语提示被试接下来要呈现的是哪一种条件。每个条件持续60s。每个条件完成之后会给被试呈现反馈,来提示被试的表现如何。然后重复下一个条件。
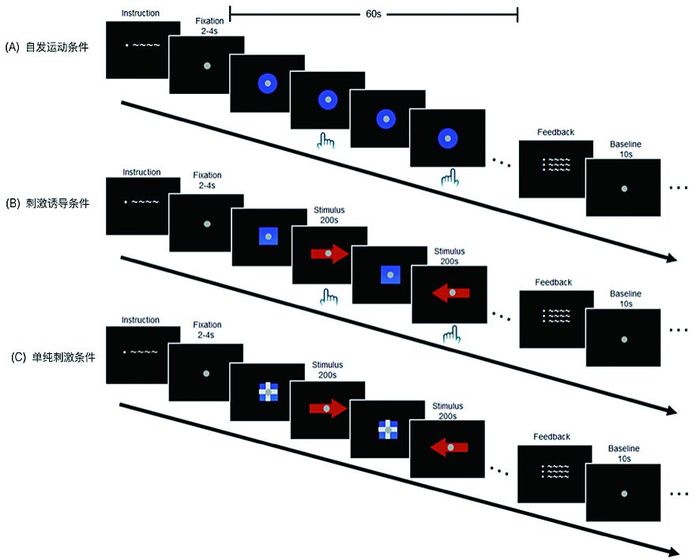
|
图 2 本研究中的实验设计 |
在自发运动条件(self-initiated condition)下,只给被试在屏幕上呈现一个静止的圆圈,要求被试自发地按键。被试可以随意选择用左手还是右手,另外被试随意选择按键的时间。但是要求被试平衡两只手按键的数目,另外两次的按键间隔控制在4s到8s,不能按键太快,也不能太慢。同时被试不能有规则的按键,比如左-右-左-右-左-右。要求被试完全随机产生按键的行为。60s之后该条件结束,会给被试呈现反馈,被试被告知在平衡双手方面和时间方面的表现,如果不符合实验要求,会提示警告信息,直到被试了解并能够完全按照指导语进行按键。
在刺激诱发运动条件(visually-cued condition)中,给被试呈现指向左侧或者右侧的箭头,当被试看见箭头之后,尽快的根据箭头的方向做出反应。60s之后该条件结束,会给被试呈现反馈,被试被告知在这一条件下按键的准确率。
在单纯视觉刺激条件(vision-only condition)中,给被试呈现跟刺激诱发运动条件中的完全相同的视觉刺激。要求被试双眼盯着屏幕上的视觉刺激,不做任何的反应。
1.2.2 实验过程正式实验之前,被试经过严格的训练,确保被试能够准确地按照指导语进行试验。整个正式实验持续大约70min,首先呈现自发运动条件,然后随机呈现刺激诱发或者单纯刺激条件,然后多次重复这3个条件,每个条件重复16次。每大约15min被试允许休息1次,防止肌肉疲劳和频繁的眼动。同时被试被告知在实验的过程中尽量减少眼动以及身体其他部位的运动。
由于自发运动条件下,所有的按键行为都是被试自定义的,比如总的按键数目、左右手按键的比例、按键的时间间隔。为了更好地跟刺激诱发条件以及单纯刺激条件相比较,我们将自发运动条件下的被试表现信息利用刺激呈现软件在线保存,比如在一个block中左右手按键的比例,和2次按键的时间间隔。这些信息被用来作为接下来刺激诱发条件和单纯刺激条件的参数,比如左箭头或者右箭头的比例,和2个箭头呈现的时间间隔。经过这一严格的匹配,可以排除由于其他额外的不同引起的条件之间的差异,能够更好地来比较条件之间的不同。
1.3 数据采集与分析 1.3.1 行为数据采集整个实验过程的刺激用Presentation软件(version 11.0, Neurobehavioral Systems, Berkeley, CA)来呈现。按键行为的数据用LumiTouch系统(Photon Control Inc., Burnaby, BC, Canada)收集记录。此外,我们还采用了加速度传感器(Brain Products GmbH, Munich, Germany)来收集更加具体的手指运动参数。两个加速度传感器分别附着在食指的指尖,用来探测手指物理运动的时间。
1.3.2 EEG数据采集采用德国Brain Products的64导事件相关电位系统(actiCAP, Brain Products GmbH, Munich, Germany)进行全脑的EEG数据的采集。电极位置采用国际通用的10-20系统。以双侧乳突平均值为参考,具体做法是在记录时以左侧乳突为参考电极,同时记录右侧乳突的信号,离线分析时再次参考右侧乳突的信号,从各导联信号中减去1/2该参考电极所记录的信号。滤波带通为0.05~500Hz,AC采样,采样频率为2500Hz/导,所有记录电极与头皮间的阻抗小于15kΩ。
1.3.3 EEG数据分析EEG数据的处理是基于EEGLAB[8]和Matlab (Math Works Inc.)。首先对原始数据进行滤波带通0.5~48Hz, 然后将采样率由2500Hz降到200Hz.根据加速度传感器,确定手指运动的时间,定义为运动始发点(movement onset)。将EEG数据锁定刺激和运动始发点分别对连续的原始数据进行分割。在自发运动条件中,分割的数据长度为运动始发点前-2500ms,到运动始发点之后1500ms。而在刺激诱发的条件中,数据分割长度为运动始发点前-2000ms,到运动始发点之后1500ms。数据的前1000ms作为基线。然后对分割之后的数据进行去噪。首先,把振幅大于100μV的数据,或者幅度超过75μV的异常漂移的数据去掉。然后再基于ICA的分析方法,对眼动进行校正。最终得到没有噪音的数据。预处理之后,剔除了3名存在很大噪音和在实验过程中存在很多额外运动的数据。由于EEG数据空间分辨率极低,我们对数据进行了空间滤波。我们采用Laplacian transformation的方法对数据进行空间滤波[9]。空间滤波的作用是提高EEG数据的空间分辨率,从而提高了EEG数据空间信息的准确性。我们采用经过去噪和空间滤波的EEG数据然计算ERPs总平均波幅。我们提取了C1,C3电极的平均值作为左侧初级运动皮层(LM1) 的活动。C2,C4电极的平均值作为右侧初级运动皮层(RM1) 的活动。这样取两个电极的平均值能够提高数据的信噪比稳定性。
2 结果 2.1 初级运动皮层在不同运动诱发条件下的运动相关电位在锁定运动始发点的ERP分析中,我们发现在自发运动条件下从大约1000ms开始初级运动皮层(RM1;LM1) 出现了经典的运动准备电位(readiness potential,RP),如图 3(A)所示。而且我们发现运动准备电位不仅发生在运动对侧的运动皮层(图 3A实线所示),也发生在运动同侧的运动皮层(图 3A虚线所示)。而在刺激诱发的运动条件下,运动对侧的运动皮层的运动准备电位发生的相对较晚,大约运动发生之前200ms左右。重要的是我们发现,运动同侧的运动皮层的电位在运动发生之前的准备阶段却出现了正向漂移,和对侧运动皮层呈现出相反的变化趋势。基于全脑的拓扑电位分析,我们发现在运动发生时,电位的变化主要发生在对侧的初级运动皮层,如图 3(B)所示。这一结果广泛地被之前的研究证实过。也证实了我们结果的准确性以及可靠性。
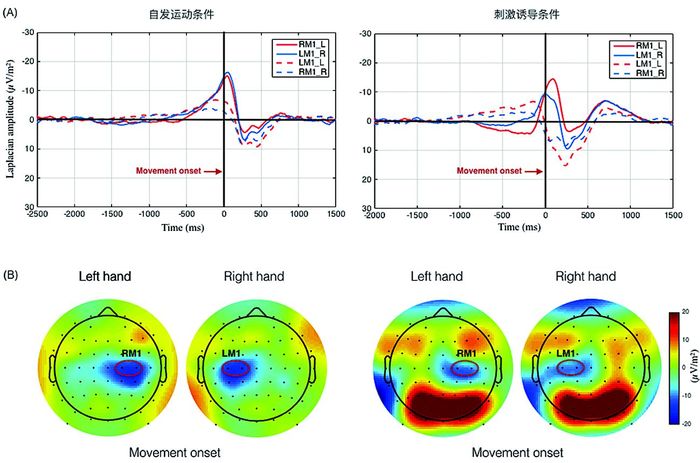
|
图 3 不同运动条件下在锁定运动始发点时的运动相关电位,以及在运动始发点时的全脑拓扑图 注:左侧(A)代表自发运动条件,右侧(B)代表刺激诱发运动条件 |
我们分别比较了对侧运动皮层和同侧运动皮层不同的运动条件下的差异。同时我们也比较了运动准备和执行阶段下对侧运动皮层和同侧运动皮层电位的变化,如图 4(A)所示。我们采用了3因素的方差分析[(自发运动,刺激诱发运动)x (运动同侧,运动对侧) x (运动准备阶段,运动执行阶段)]。方差分析发现3因素的交互作用显著[F(1, 17)=55.91, P<10-4]。事后检验分析发现,对侧初级运动皮层只有在运动准备阶段才呈现显著的运动诱发模式之间的差异(如图 4(B)所示),即:自发运动条件下的运动电位变化显著高于刺激诱发条件下的运动电位负向漂移[t(1, 17)=5.62, P=3.04×10-5]。而在运动执行阶段不受运动诱发模式的影响[t(1, 17)=1.30, P=0.21]。值得注意地,同侧初级运动皮层却呈现相反的模式(如图 4(B)所示),即:在运动准备阶段不同的运动诱发模式之间没有统计学差异[t(1, 17)=1.08, P=0.30],而在运动执行阶段刺激诱发条件下运动电位显著高于自发运动条件的运动电位[t(1, 17)=4.85, P=1.50×10-5]。
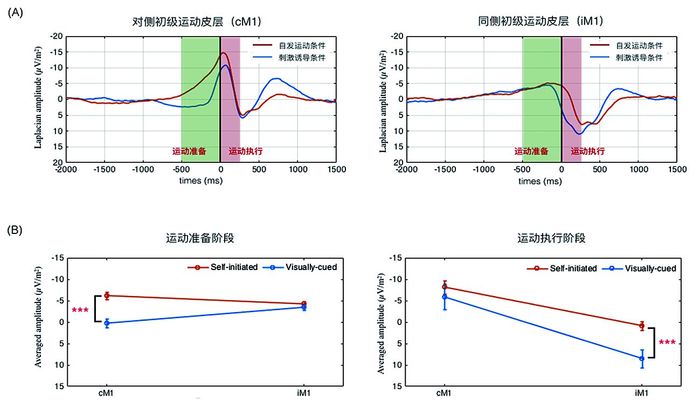
|
图 4 运动相关电位的三因素方差分析 (自发运动,刺激诱发运动)x (运动同侧,运动对侧);x (运动准备阶段,运动执行阶段) |
在刺激诱发运动条件下,我们发现运动对侧的运动皮层电位在运动发生之前的准备阶段出现了负向漂移,而同侧运动皮层呈现出相反的变化趋势,如图 5(A)所示。我们发现,对侧运动皮层的负向漂移从-200ms开始到0ms结束,而同侧的运动皮层的正向漂移从-200ms开始到250ms结束(运动结束的时间)。因此我们推测对侧的运动皮层对运动起到了激发的作用(activation),这种激发只发生在运动开始之前,而同侧的初级运动皮层对运动起抑制作用(inhibition),以防止另一只手的运动,所以抑制作用一直从运动准备一直持续到运动结束。为了证实我们的假设,我们分别计算了在相应时间段内对侧和同侧运动电位的坡度,我们发现对侧和同侧运动电位的变化坡度与反应时呈显著相关,如图 5(B)所示。我们发现,反应时越长,坡度越陡。这一结果证实了我们的假设,即对侧的运动皮层对运动起到了激发的作用,而同侧的初级运动皮层对运动起抑制作用。而对侧的激发作用和同侧抑制作用直接影响运动的表现。
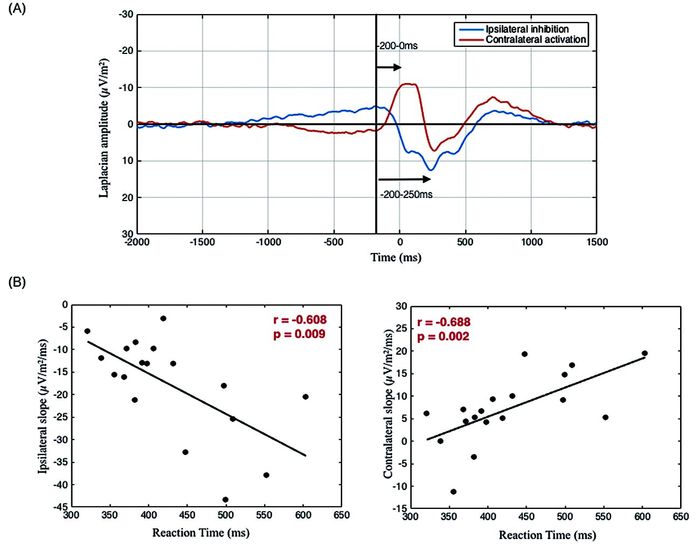
|
图 5 刺激诱发运动条件下,运动相关电位与行为数据的相关 |
Kornhuber和Deecke于1964年首次在自发运动中发现运动准备电位[10]。运动准备电位是一个发生于运动开始之前的负向漂移的慢波。这一负向漂移的慢波被广泛证明与运动的准备有关,主要发生在辅助运动皮层和初级运动皮层[7, 11-12]。Waszak等[1]利用EEG技术比较了自发运动和刺激诱发运动的区别。在刺激诱发的运动条件中,他们发现了顶叶成分P3和额中叶的偏侧化运动准备电位(lateralized readiness potential,LRP)。而运动准备电位(RP)只在自发运动条件下被发现,在刺激诱发运动条件下并没有发现。同时在刺激诱发的运动中,研究证明前运动皮层(ventral premotor cortex,PMv; dorsal premotor cortex, PMd),后顶叶皮层(posterior parietal cortex)等组成的运动控制网络起到重要的作用[1, 6]。在我们的研究中,我们在自发运动条件下发现了显著的运动准备电位,而这一运动准备电位在运动开始之前显著高于刺激诱发的运动条件。而且从激活拓扑图上我们也可以看出,在刺激诱发条件下,其他运动相关的脑区也有激活,如前运动皮层,后顶叶皮层,以及由于视觉刺激引起的视觉皮层的激活。我们的结果都直接证明了之前的研究结果,表明两种不同的运动诱发条件分别由不同的运动网络控制。
3.2 对侧初级运动皮层和同侧初级运动皮层对运动控制的作用在运动任务中,各种脑成像技术(fMRI,EEG,PET等)已经发现初级运动皮层会被激活[13-14]。我们通常认为运动任务会引起对侧的运动皮层的激活,而同侧的运动皮层不会被激活。但是已经有大量的研究证实,即使在最简单的单手运动中,不仅对侧的运动皮层会被激活,而且同侧的运动皮层也会有参与[15-16]。而且同侧运动皮层的激活也被证实与运动任务或者表现有关。大量研究发现,运动任务的复杂性与同侧运动皮层的激活有关,运动任务越难,同侧运动皮层的激活水平越高,而对侧运动皮层没有显著的变化[17-18]。另外同侧运动皮层的激活与年龄的增长有关系。Rossiter等[19-20]发现随着年龄的增长,同侧运动皮层在运动任务中的激活水平也相应地增加,这反映了同侧运动皮层在老年人当中会参与更多的信息处理过程。我们的研究也发现了同侧运动皮层的激活,尤其是在运动准备阶段以及运动执行阶段。
用EEG技术,Burle等[21]提出在刺激诱发的运动中,对侧的运动皮层对运动起到激发作用,而同侧的运动皮层对另一侧的运动起到抑制作用。我们的结果也证实,同侧运动皮层的电位变化跟运动的表现有关。另外我们第一次发现不同的运动诱发模式对对侧运动皮层的运动激发作用的调控只发生在运动准备阶段。而同侧运动皮层对另一侧手指运动的抑制作用在刺激诱发条件下更重要,并且不同运动诱发模式对运动的抑制的调控只发生在运动执行阶段。我们的结果表明对侧和同侧的运动皮层都受不同的运动诱发模式的影响,但是体现在不同的运动阶段。我们的结果或许对一些运动功能失调病人的治疗起到指导作用。
4 结论在本研究中,我们利用EEG成像技术,研究了在不同运动诱发模式下初级运动皮层对运动准备和执行的控制机制。我们的研究表明了对侧和同侧初级运动皮层都受不同的运动诱发条件的影响,但是分别体现在运动准备和运动执行阶段。我们的这一结果证明了对侧和同侧初级运动皮层分别在运动准备和运动执行阶段对运动的调控起到了重要作用。我们的结果对更好地理解人类大脑的运动系统的神经工作机制提供了理论证据,同时为在实践中对神经系统疾病引起的运动障碍的治疗以及诊断提供理论依据。
感谢本研究由德国科隆大学卓越计划资助和于利希国家研究中心支持。
| [1] | Waszak F, Wascher E, Keller P, et al. Intention-based and stimulus-based mechanisms in action selection[J]. Exp Brain Res, 2005, 162(3): 346–356. DOI:10.1007/s00221-004-2183-8 |
| [2] | Herwig A, Prinz W, Waszak F. Two modes of sensorimotor integration in intention-based and stimulus-based actions[J]. Q J Exp Psychol (Hove), 2007, 60(11): 1540–1554. DOI:10.1080/17470210601119134 |
| [3] | Astor-Jack, T.& Haggard, P.in (eds.Humpreys, G.& Riddoch, M.) pp.109-131.(Hove/New York:Psychology Press, 2005). |
| [4] | Eagleman DM. Neuroscience.The where and when of intention[J]. Science, 2004, 303(5661): 1144–1146. DOI:10.1126/science.1095331 |
| [5] | Mueller VA, Brass M, Waszak F, et al. The role of the preSMA and the rostral cingulate zone in internally selected actions[J]. Neuroimage, 2007, 37(4): 1354–1361. DOI:10.1016/j.neuroimage.2007.06.018 |
| [6] | Obhi SS, Haggard P. Internally generated and externally triggered actions are physically distinct and independently controlled[J]. Exp Brain Res, 2004, 156(4): 518–523. DOI:10.1007/s00221-004-1911-4 |
| [7] | Shibasaki H, Hallett M. What is the Bereitschaftspotential[J]. Clin Neurophysiol, 2006, 117(11): 2341–2356. DOI:10.1016/j.clinph.2006.04.025 |
| [8] | Delorme A, Makeig S. EEGLAB:an open source toolbox for analysis of single-trial EEG dynamics including independent component analysis[J]. J Neurosci Methods, 2004, 134(1): 9–21. DOI:10.1016/j.jneumeth.2003.10.009 |
| [9] | Perrin F, Pernier J, Bertrand O, et al. Spherical splines for scalp potential and current density mapping[J]. Electroencephalogr Clin Neurophysiol, 1989, 72(2): 184–187. DOI:10.1016/0013-4694(89)90180-6 |
| [10] | Kornhuber HH, Deecke L. Hirnpotential nderungen bei Willkürbewegungenund passiven Bewegungen des Menschen:Bereitschaftspotential und reafferente Potentiale[J]. Pflugers Arch.Gesamte Physiol.Menschen Tiere, 1965, 284(1): 1–17. DOI:10.1007/bf00412364 |
| [11] | Cunnington R, Windischberger C, Deecke L, et al. The preparation and execution of self-initiated and externally-triggered movement:a study of event-related fMRI[J]. Neuroimage, 2002, 15(2): 373–385. DOI:10.1006/nimg.2001.0976 |
| [12] | Cunnington R, Windischberger C, Deecke L, et al. The preparation and readiness for voluntary movement:a high-field event-related fMRI study of the Bereitschafts-BOLD response[J]. Neuroimage, 2003, 20(1): 404–412. DOI:10.1016/S1053-8119(03)00291-X |
| [13] | van Wijk BC, Beek PJ, Daffertshofer A. Differential modulations of ipsilateral and contralateral beta (de)synchronization during unimanual force production[J]. Eur J Neurosci, 2012, 36(1): 2088–2097. DOI:10.1111/j.1460-9568.2012.08122.x |
| [14] | Wang B, Fan Y, Lu M, et al. Brain anatomical networks in world class gymnasts:a DTI tractography study[J]. Neuroimage, 2013, 65: 476–487. DOI:10.1016/j.neuroimage.2012.10.007 |
| [15] | Pfurtscheller G, Lopes da Silva FH. Event-related EEG/MEG synchronization and desynchronization:basic principles[J]. Clin Neurophysiol, 1999, 110(11): 1842–1857. DOI:10.1016/s1388-2457(99)00141-8 |
| [16] | Bai O, Mari Z, Vorbach S, et al. Asymmetric spatiotemporal patterns of event-related desynchronization preceding voluntary sequential finger movements:a high-resolution EEG study[J]. Clin Neurophysiol, 2005, 116(5): 1213–1221. DOI:10.1016/j.clinph.2005.01.006 |
| [17] | Chen R, Gerloff C, Hallett M, et al. Involvement of the ipsilateral motor cortex in finger movements of different complexities[J]. Ann Neurol, 1997, 41(2): 247–254. DOI:10.1002/ana.410410216 |
| [18] | Hummel F, Kirsammer R, Gerloff C. Ipsilateral cortical activation during finger sequences of increasing complexity:representation of movement difficulty or memory load[J]. Clin Neurophysiol, 2003, 114(4): 605–613. DOI:10.1016/s1388-2457(02)00417-0 |
| [19] | Ward NS, Swayne OB, Newton JM. Age-dependent changes in the neural correlates of force modulation:an fMRI study[J]. Neurobiol Aging, 2008, 29(9): 1434–1446. DOI:10.1016/j.neurobiolaging.2007.04.017 |
| [20] | Rossiter HE, Davis EM, Clark EV, et al. Beta oscillations reflect changes in motor cortex inhibition in healthy ageing[J]. Neuroimage, 2014, 91: 360–365. DOI:10.1016/j.neuroimage.2014.01.012 |
| [21] | Burle B, van den Wildenberg WP, Spieser L, et al. Preventing (impulsive) errors:Electrophysiological evidence for online inhibitory control over incorrect responses[J]. Psychophysiology, 2016, 53(7): 1008–1019. DOI:10.1111/psyp.12647 |

