2. 济宁医学院神经生物研究所, 济宁 272067
2. Institute of Neurobiology, Jining Medical University, Jining 272067, China
脑卒中是一种严重危害人类健康的脑血管疾病, 具有高发病率、致残率和致死率的特点,其中缺血性脑卒中占脑卒中的87%以上[1-2]。近年来人们致力于研究急性脑缺血后损伤的级联反应,以期找到有效的治疗方法。钙离子超载和内质网应激是脑卒中缺血-再灌注损伤的主要机制[3]。钙离子超载会引起内质网应激,内质网应激进一步激活未折叠蛋白反应,导致内质网分子伴侣GRP78和转录因子CHOP等的上调,进而参与蛋白折叠、细胞凋亡或自噬的调控[4]。
Apelin是G蛋白偶联受体APJ的内源性配体,在中枢系统中具有神经保护作用[5]。鉴于Apelin-13是活性最强的Apelin异构体,多数研究显示Apelin-13能够抑制缺血性脑卒中后氧化应激介导的神经细胞凋亡,并且能够对抗缺血-再灌注损伤后神经细胞的氧化应激反应[6],并抑制细胞凋亡,从而减轻大鼠局灶性脑缺血-再灌注损伤及脑水肿[7]。虽然Apelin-36与APJ亲和力最强,但其活性弱于Apelin-13[8],因此研究较少。最近研究显示Apelin-36在缺血性脑卒中模型小鼠和新生大鼠缺血缺氧模型中能够抵抗缺血性脑损伤,但机制还不完全清楚[9]。
本文通过研究Apelin-36可能通过调控钙离子超载和内质网应激来调控缺血-再灌注损伤所引起的神经细胞凋亡,探究Apelin-36对缺血性脑卒中模型小鼠的神经保护作用。
1 材料与方法 1.1 材料 1.1.1 细胞与动物选用人源神经瘤细胞母细胞瘤(SH-SY5Y)细胞系(购自美国ATCC细胞库),SPF级雄性Wistar大鼠,由山东鲁抗医药股份有限公司提供,合格证号:SCXK鲁20130001。所有实验动物的管理都遵循国家实验动物饲养管理和使用指南及济宁医学院实验动物管理条例。实验动物在济宁医学院神经生物研究所动物饲养室进行预养,动物饲养室的温度控制在22℃~26℃,湿度在50%~60%。整个实验造模过程中除相关因素所需外,实验动物均自由摄食和饮水,并充分保障实验动物福利,在不影响实验要求和实验结果的基础上实施替代、减少、优化的“3R”原则。
1.1.2 试剂与仪器钙离子载体A23187半钙盐(A23187,SIGMA公司,美国),Apelin-36(Phoenix Pharmaceuticals公司, 美国),总RNA simple提取试剂盒(天根公司,北京),梯度PCR仪(伯乐公司,美国),紫外分光光度计(岛津公司,日本),超低温离心机(Eppendorf公司,美国),超低温冰箱(海尔公司,青岛)。
1.2 方法 1.2.1 大鼠实验分组健康雄性Wistar大鼠,体重在280g到320g之间,随机分为假手术组、模型组,每组6只,按照缺血时间为2h,再灌注24h。
1.2.2 缺血性脑卒中模型大鼠实验选取健康雄性Wistar大鼠。通过大脑中动脉阻塞(middle cerebral artery occlusion,MCAO)法制备局灶性脑缺血模型,缺血2h后再灌注24h。于再灌注24h后进行神经功能评分,然后处死大鼠测定脑梗死体积。具体方见[20]。
1.2.3 细胞培养选用人源神经瘤细胞母细胞瘤(SH-SY5Y)细胞系,在37℃恒温,5% CO2的培养箱中培养。在荧光显微镜下观察细胞生长情况,待细胞生长到指数期,即密度达到60%~80%时传代,按照实验分组分别传代到60mm培养皿中。培养24h后,在荧光显微镜下观察细胞生长情况,待细胞生长到指数期,即密度达到60%~80%时,根据不同实验分组需要,实验分为:空白对照组、模型组和Apelin-36组。实验用钙离子载体A23187和Apelin-36终浓度分别为2.5mM和100nM,模型组使用钙离子载体A23187处理;Apelin-36组为钙离子载体A23187和Apelin-36处理共培养16h后,收集细胞提取RNA。上述重复3次独立实验。
1.2.4 RT-PCR法测定大鼠脑皮层组织与SH-SY5Y细胞CHOP、GRP78mRNA的表达按照总RNAsimple提取试剂盒说明书操作,提取不同分组大鼠脑皮层组织与SH-SY5Y细胞的总RNA。将1.0ug总RNA以反转录试剂转录为cDNA,并以获取的cDNA为模板进行PCR扩增,以β-ACTIN作为内参矫正。反应条件:95℃ 10min; 95℃ 30s,55℃ 30s,72℃ 45s,25次循环。PCR产物进行琼脂糖凝胶电泳。使用Image J软件对电泳结果定量分析,获取琼脂糖凝胶电泳中DNA条带的光密度值。所用引物均由上海生工生物工程技术服务有限公司合成,具体引物序列见表 1。
| 表 1 RT-PCR引物 |
全部资料用SPSS 13.0软件进行统计分析。大鼠假手术组和脑卒中模型组两组间比较采用t检验,SH-SY5Y细胞多组间比较采用单因素方差分析,进一步两两比较采用LSD检验。以P<0.05为差异有统计学意义。
2 结果 2.1 各组大鼠皮层脑组织CHOP和GRP78mRNA的表达提取假手术组和脑卒中模型组大鼠皮层脑组织RNA进行半定量PCR,结果显示(图 1),在缺血性脑卒中模型组中,与假手术组相比,模型组大鼠CHOP和GRP78mRNA表达显著增加(t=5.832, P<0.05;t=5.938, P<0.05),说明缺血性脑卒中可导致大鼠脑组织细胞出现内质网应激。
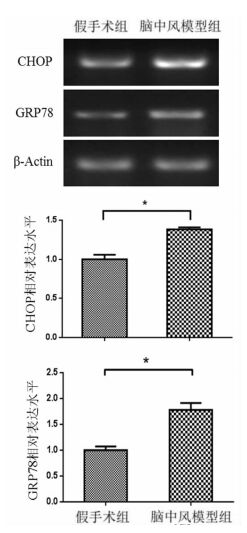
|
图 1 大鼠脑组织中CHOP和GRP78的相对表达 注:与假手术组相比,*P<0.05 |
神经细胞内钙离子超载和内质网应激是脑卒中缺血-再灌注损伤的主要机制,而且细胞内钙离子超载可能激活内质网应激,参与神经细胞凋亡[10]。因此,我们运用钙离子载体A23187诱导神经源性SH-SY5Y细胞内钙离子超载,明确钙离子超载是否激活内质网应激。我们使用钙离子载体A23187处理SH-SY5Y细胞,利用RT-PCR检测了CHOP和GRP78的相对表达情况。图 2显示,钙离子载体A23187可明显上调CHOP和GRP78的表达,说明细胞钙离子超载可激活内质网应激。
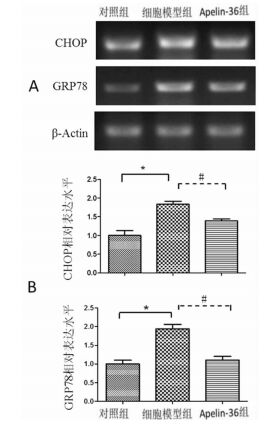
|
图 2 SH-SY5Y细胞中CHOP和GRP78的相对表达 注:CHOPmRNA 3组间比较,F=18.98,* P<0.05;与对照组相比,* P<0.05;与模型组相比,# P<0.05。GRP78mRNA 3组间比较,F=24.24,* P<0.05;与对照组相比,* P<0.05;与模型组相比,# P<0.05。 |
与对照组比较,细胞模型组CHOP和GRP78 mRNA表达显著增加,差异具有统计学意义(均P<0.05);与细胞模型组相比,Apelin-36组CHOP和GRP78mRNA表达显著降低(均P<0.05)。见图 2。
3 讨论缺血性脑卒中是目前人类致残和死亡的重要原因之一。到目前为止,早期溶栓治疗是其最有效的治疗方式,近年来人们致力于急性脑缺血后损伤级联反应的研究。到目前为止,超早期静脉给予重组组织型纤溶酶原激活剂的溶栓治疗是唯一获得循证医学支持并被美国食品药品管理局批准的治疗急性缺血性脑卒中的药物治疗方法。但其狭窄的治疗时间窗是限制溶栓治疗的最大瓶颈,且溶栓后再灌注引起的继发性神经损伤也限制着溶栓治疗的推广应用。近年来研究表明,脑缺血-再灌注后继发性神经损伤与内质网应激有着密切关系。因此,针对内质网应激机制的不同环节加以干预,有可能成为治疗缺血性脑卒中新的有效途径。钙离子超载和内质网应激是脑卒中缺血-再灌注损伤的主要机制[11]。钙离子稳态平衡是维持机体生理活动的重要保证。钙离子超载会引起细胞凋亡,是缺血-再灌注损伤的主要致病机制[12]。
缺血性脑卒中后,脑内氧含量迅速下降,能量代谢缓慢导致体内的ATP迅速消耗,细胞膜上的电化学梯度难以维持,细胞内钾离子外流造成细胞膜去极化,细胞外的钙离子大量内流,而线粒体内Ca2+沉积造成氧化磷酸化电子传递脱偶联,ATP生成障碍,离子泵停止运转,膜离子梯度不能维持,细胞代谢水平降低,最终导致神经元细胞发生迟发性死亡;内质网因线粒体损伤能量供应不足,大量未折叠蛋白堆积在内质网腔中导致内质网释放大量钙离子,引起内质网的应激反应,同时加剧细胞内钙超载[13-14]。内质网应激进一步激活未折叠蛋白反应,导致内质网分子伴侣GRP78和转录因子CHOP等的上调,进而参与蛋白折叠,细胞凋亡或自噬的调控[15]。
Apelin是G蛋白偶联受体APJ的内源性配体,在体内中枢系统和外周组织中分布广泛,其中在心脏,脑、肺、血管等器官中有较高的表达[16]。Apelin/APJ系统的生物学意义非常广泛,对心血管功能、血管的生成,体液平衡等起了重要的调控作用[17-19]。研究表明,Apelin前体肽在体内经过酶水解最终形成具有不同氨基酸组成和生物活性的Apelin-13、Apelin-17和Apelin-36,其中Apelin-13在血液中的含量较后二者更多,但Apelin-36与APJ有较高的亲和力[20],在中枢系统中具有神经保护作用[21]。
当机体发生缺血性脑卒中后,脑缺血-再灌注损伤造成的梗死灶可分为两个区域,其中梗死中心区域的神经细胞快速死亡该区域为不可逆性损伤。但在梗死中心区周围存在一个缺血边缘区,即缺血半暗带[20],该区域的神经细胞损伤以细胞凋亡为主,神经元处于电衰竭状态。该区域为可逆性损伤,并且缺血神经元的凋亡具有延迟性,这就为缺血性脑卒中病人提供了治疗时间,使我们用药物来减轻神经元的损伤进而减少脑梗死体积成为可能。因此,如能有效阻止脑缺血半暗带的细胞凋亡,即可减轻脑组织的损伤程度,改善病人的生活质量。缺血性脑卒中,作为一种常见疾病,影响着人们生活健康。在本研究中我们首先发现,缺血性脑卒中可导致大鼠脑组织细胞内质网应激的发生,同时我们推测该现象是由于脑卒中引起的钙离子超载所引起的。为了验证我们的假设,我们利用钙离子载体A23187,对可内源性表达APJ受体的SHSY5Y细胞进行了钙离子超载模型模拟,结果钙离子载体A23187的确会明显上调CHOP和GRP78的表达,证实钙离子超载的确会影响神经细胞内质网应激的出现。我们还发现加入Apelin-36后,钙离子载体对CHOP和GRP78表达的激活被明显抑制。以上结果显示Apelin-36可明显抑制钙离子超载导致的内质网应激作用,从而可能有助于改善缺血性脑卒中导致的神经损伤,具有神经保护的作用。但是Apelin-36对GRP78和CHOP的mRNA影响是基于Apelin-36对GRP78和CHOP转录的影响或是改变了其mRNA的稳定性,以及在大鼠模型中,Apelin-36是否还有类似的抑制作用还有待于进一步的研究。然而,本文揭示了Apelin-36参与对内质网应激的调控机理,可为缺血性脑卒中的临床治疗提供提新的理论基础和药物靶点。
| [1] | Green AR, Shuaib A. Therapeutic strategies for the treatment of stroke[J]. Drug Discov Today, 2006, 11(15/16): 681–693. DOI:10.1016/j.drudis.2006.06.001 |
| [2] | Wu Y, Wang X, Zhou X, et al. Temporal expression of Apelin/Apelinreceptor in ischemic stroke and its therapeutic potential[J]. Front Mol Neurosci, 2017. DOI:10.3389/fnmol.2017.00001 |
| [3] | Koizumi JI, Yoshida Y, Nakazawa T, et al. Experimental studies of ischemic brain edema:A new experimental model of cerebral embolism in rats in which recirculation can be introduced in the ischemic area[J]. Jpn.j.stroke, 1986, 8: 1–8. DOI:10.3995/jstroke.8.1 |
| [4] | Lee DK, Cheng R, Nguyen T, et al. Characterization of apelin, the ligand for the APJ receptor[J]. J Neurochem, 2000, 74(1): 34–41. DOI:10.1046/j.1471-4159.2000.0740034.x |
| [5] | Tatemoto K, Hosoya M, Habata Y, et al. Isolation and characterization of a novel endogenous peptide ligand for the human APJ receptor[J]. Biochem Biophys Res Commun, 1998, 251(2): 471–476. DOI:10.1006/bbrc.1998.9489 |
| [6] | Khaksari M, Aboutaleb N, Nasirinezhad F, et al. Apelin-13 protects the brain against ischemic reperfusion injury and cerebral edema in a transient model of focal cerebral ischemia[J]. J Mol Neurosci, 2012, 48(1): 201–208. DOI:10.1007/s12031-012-9808-3 |
| [7] | Cervantes M, Moralí G, Letechipía-Vallejo G. Melatonin and ischemia-reperfusion injury of the brain[J]. J Pineal Res, 2008, 45(1): 1–7. DOI:10.1111/j.1600-079X.2007.00551.x |
| [8] | Khaksari M, Aboutaleb N, Nasirinezhad F, et al. Apelin-13 protects the brain against ischemic reperfusion injury and cerebral edema in a transient model of focal cerebral ischemia[J]. J Mol Neurosci, 2012, 48(1): 201–208. DOI:10.1007/s12031-012-9808-3 |
| [9] | Szokodi I, Tavi P, Fldes G, et al. Apelin, the novel endogenous ligand of the orphan receptor APJ, regulates cardiac contractility[J]. Circ Res, 2002, 91(5): 434–440. DOI:10.1161/01.res.0000033522.37861.69 |
| [10] | Daviaud D, Boucher J, Gesta S, et al. TNFalpha up-regulates apelin expression in human and mouse adipose tissue[J]. FASEB J, 2006, 20(9): 1528–1530. DOI:10.1096/fj.05-5243fje |
| [11] | Wei L, Hou X, Tatemoto K. Regulation of apelin mRNA expression by insulin and glucocorticoids in mouse 3T3-L1 adipocytes[J]. Regul Pept, 2005, 132(1-3): 27–32. DOI:10.1016/j.regpep.2005.08.003 |
| [12] | Chung JW, Ryu WS, Kim BJ, et al. Elevated calcium after acute ischemic stroke:association with a poor short-term outcome and long-term mortality[J]. J Stroke, 2015, 17(1): 54–59. DOI:10.5853/jos.2015.17.1.54 |
| [13] | Horn J, Limburg M. Calcium antagonists for ischemic stroke:a systematic review[J]. Stroke, 2001, 32(2): 570–576. DOI:10.1161/01.str.32.2.570 |
| [14] | Lee DK, Cheng R, Nguyen T, et al. Characterization of apelin, the ligand for the APJ receptor[J]. J Neurochem, 2000, 74(1): 34–41. DOI:10.1046/j.1471-4159.2000.0740034.x |
| [15] | Wang XL, Tao Y, Lu Q, et al. Apelin supports primary rat retinal Müller cells under chemical hypoxia and glucose deprivation[J]. Peptides, 2012, 33(2): 298–306. DOI:10.1016/j.peptides.2011.12.015 |
| [16] | Chen MM, Ashley EA, Deng DX, et al. Novel role for the potent endogenous inotrope apelin in human cardiac dysfunction[J]. Circulation, 2003, 108(12): 1432–1439. DOI:10.1161/01.CIR.0000091235.94914.75 |
| [17] | 蔡世昌, 张秋玲, 李金国, 等. Apelin对急性局灶性脑缺血再灌注损伤大鼠脑神经细胞的保护作用[J]. 第二军医大学学报, 2012, 33(12): 1324–1328. DOI:10.3724/SP.J.1008.2012.01324 |
| [18] | Gu Q, Zhai L, Feng X, et al. Apelin-36, a potent peptide, protects against ischemic brain injury by activating the PI3K/Akt pathway[J]. Neurochem Int, 2013, 63(6): 535–540. DOI:10.1016/j.neuint.2013.09.017 |
| [19] | Tatemoto K, Hosoya M, Habata Y, et al. Isolation and characterization of a novel endogenous peptide ligand for the human APJ receptor[J]. Biochem Biophys Res Commun, 1998, 251(2): 471–476. DOI:10.1006/bbrc.1998.9489 |
| [20] | Yan XG, Cheng BH, Wang X, et al. Lateral intracerebroventricular injection of Apelin-13 inhibits apoptosis after cerebral ischemia/reperfusion injury[J]. Neural Regen Res, 2015, 10(5): 766–771. DOI:10.4103/1673-5374.157243 |
| [21] | Chung JW, Ryu WS, Kim BJ, et al. Elevated calcium after acute ischemic stroke:association with a poor short-term outcome and long-term mortality[J]. J Stroke, 2015, 17(1): 54–59. DOI:10.5853/jos.2015.17.1.54 |



