脑卒中是现代社会严重危害人类健康的脑血管疾病,具有致死率高、致残率高的特点。脑卒中包括缺血性脑卒中和出血性脑卒中,其中缺血性脑卒中约占所有脑卒中的80%,大脑中动脉阻塞(middle cerebral artery occlusion,MCAO)为缺血性脑卒中的主要原因[1]。缺血性脑卒中引起一系列行为学和认知功能障碍,而海马神经元在行为和认知功能中具有关键作用。脑源性神经营养因子(brain derived neurotrophic factor,BDNF)和Ras基因家族成员A(ras homolog gene family member A,RhoA)是海马中的重要蛋白因子,与行为和认知功能密切相关[2-3]。另外,神经递质乙酰胆碱(acetylcholine,ACh)在海马组织中也参与了认知功能的调节,由胆碱乙酰化酶合成,乙酰胆碱酯酶(acetylcholinesterase,AChE)降解。脑缺血时,AChE释放增加,致使ACh降低,从而引起行为和认知功能障碍[4]。
我们以前研究发现,侧脑室注射Apelin-13对Longa法制作的MCAO缺血性脑卒中大鼠模型具有神经保护作用,改善了神经功能评分,降低了脑梗死体积,降低了皮质和海马神经元凋亡,减轻了神经炎症[5-7]。本研究在此基础上,研究侧脑室注射Apelin-13对大鼠局灶性脑缺血-再灌注模型行为学和认知功能的影响,并检测海马BDNF和RhoA表达影响。
1 材料与方法 1.1 实验动物及分组SPF级健康雄性SD大鼠(280~320g),由山东鲁抗医药股份有限公司提供(合格证号:SCXK鲁20130001)。所有的动物实验都遵照国家实验动物饲养和使用指南,动物饲养在温度控制的环境(22±1)℃下,相对湿度为(55±5)%,12h明暗循环,自由饮食和饮水。实验动物在济宁医学院神经生物研究所进行预养,适应性饲养1周后开始实验,将大鼠分为3组:对照组、MCAO模型组和Apelin-13干预组,每组6只。
1.2 方法 1.2.1 局灶性脑缺血MCAO模型的制备和药物处理模型组和Apelin-13干预组参照改进的Longa法制作的MCAO脑缺血-再灌注模型。大鼠造模前禁食12h,禁水2h,用10%水合氯醛(0.3ml/100g)经腹腔注射麻醉后,颈部正中切开皮肤,钝性分离暴露右侧颈总动脉(CCA)、颈外动脉(ECA)、颈内动脉(ICA),结扎右侧ECA及CCA近心端,微动脉夹夹闭右侧ICA,CCA分叉处预留结扎线。然后,在右侧CCA剪一小口,将线栓自右侧CCA切口处缓慢插入[深度约为(18±0.5) mm]。缺血1h后,缓慢地轻拉线栓,使其头端回撤至CCA内即可。操作完成后,手术缝合伤口,结束手术,建成缺血模型(图 1)。然后,Apelin-13干预组于右侧侧脑室埋置注射用套管,用于微量注射Apelin-13,3μg/d,共30d。假手术组仅分离颈总动脉,不给予任何干预。

|
图 1 MCAO模型制作 |
疲劳转棒仪是用于检测大鼠运动协调能力的方法。SD大鼠在MCAO手术前连续训练1周,记录大鼠在转棒上的停留时间,每次最长的记录时间为3min。每只大鼠的测试中,圆棒的转动速度为10rpm,匀速。每天每只大鼠测试3次,每两次测试之间的间隔为15min。然后于侧脑室注射Apelin-13第27天再进行训练3d,第30天进行检测大鼠在转棒上的停留时间,每只大鼠检测3次,取平均值。见图 2。

|
图 2 技术路线 |
大鼠的学习记忆功能采用水迷宫进行定位航行试验和空间探索试验,水深45cm,水面高出平台2cm。首先进行定位航行试验,将各组大鼠于24d开始进行水迷宫训练,将大鼠分别从水池4个象限将固定位置放入水中,共4次,2次训练间隔时间为30min,记录大鼠从放入水中到找到目标平台所需要的时间,称为逃避潜伏期。如果大鼠在90s内寻找到目标平台并在平台上停留30s将其捞起,记录时间。如果大鼠在90s内不能寻找到到平台,则引导大鼠游上平台,让大鼠在平台上停留30s后将其捞起,此时的逃避潜伏期记录为90s。按上述方法连续训练5d后,以第6天记录的每只大鼠4次躲避潜伏期的平均值作为该只大鼠定位航行试验的实验结果。定位航行试验结束以后,间隔24h,第7天撤掉平台,记录大鼠在120s穿越平台次数作为空间探索试验的实验结果。见图 2。
1.2.4 免疫印迹分析各组大鼠30d后腹腔注射10%水合氯醛,断头取脑,冰上分离右侧海马组织,加入1ml RIPA裂解液和10μl PMSF进行裂解,超声粉碎组织,4℃, 12000g离心30min,取上清液加入4×蛋白上样缓冲液,100℃变性10min。然后,将样品进行10%聚丙烯酰氨凝胶电泳(SDS-PAGE),每孔加入30μg总蛋白。电泳结束后,将蛋白转移到PVDF膜上,转膜时间为90min。转膜后,5%脱脂奶粉封闭1h后, 分别加如入BDNF (1:1000)、Rho A(1:1000) 和β-actin一抗抗体,4℃过夜。第2天取出后室温放置1h,TBST洗膜3次,每次10min,加入辣根过氧化物酶标记的二抗(1:2000) 室温孵育1h,TBST洗膜3次,每次10min,加入ECL暗室曝光,利用Image J软件扫描条带灰度值,以β-actin为内参,计算BDNF和Rho A的表达变化。见图 2。
1.2.5 ELISA检测AChE活性大鼠侧脑室注射Apelin-13 30d经麻醉处理后,分离海马组织称重后,加入冷生理盐水,按照重量体积比制备成10%的组织匀浆,4℃条件下3000r/min离心10min,取上清液BCA法测定蛋白浓度,根据试剂盒说明书(南京建成AChE活性检测试剂盒)测定AChE活性,结果以U/mg表示。见图 2。
1.3 统计学方法数据用SPSS20统计软件进行分析。计量单位以x±s表示,多组间比较采用方差分析,进一步两两比较采用SNK-q检验。以P<0.05为差异有统计学意义。
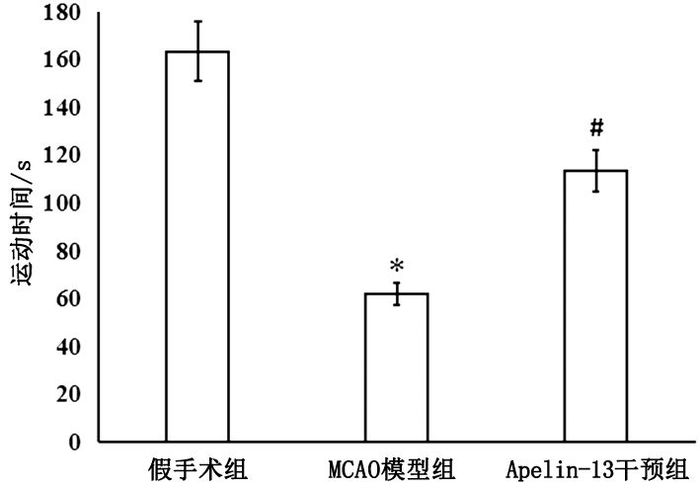
2 结果 2.1 Apelin-13对MCAO模型大鼠行为学功能的影响手术1月后,与假手术组大鼠停留时间[(163.44±12.30) s]相比较,MCAO模型组大鼠停留时间[(62.04±4.52) s]明显缩短,差异具有统计学意义(P<0.05),表明MCAO模型大鼠运动协调功能明显下降;与MCAO模型组大鼠相比较,Apelin-13干预组大鼠停留时间[(113.46±8.47) s]明显延长,差异具有统计学意义(P<0.05),表明侧脑室注射Apelin-13改善了MCAO模型大鼠的运动协调功能。见图 3。
|
图 3 Apelin-13对MCAO大鼠模型运动功能的影响 注:3组间比较,F=132.4,P<0.05;与假手术组相比较,*P<0.05,n=6;与MCAO模型大鼠相比较,#P<0.05,n=6 |
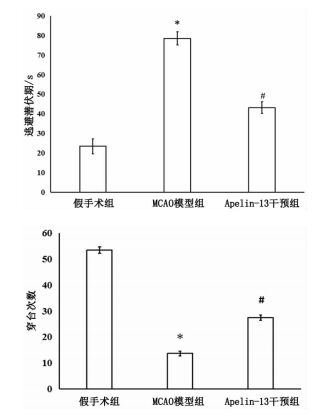
手术30d后,与假手术组大鼠逃避潜伏期[(23.48±3.80) s]和穿台次数[(13.47±1.28) 次]相比较,MCAO模型组大鼠逃避潜伏期[(75.58±3.36) s]明显延长,穿台次数[(3.72±0.94) 次]明显减少,差异具有统计学意义(P<0.05),表明MCAO模型组大鼠学习记忆功能明显下降;与MCAO模型组大鼠相比较,Apelin-13干预组大鼠逃避潜伏期[(43.18±2.95) s]明显缩短,穿台次数[(7.50±1.04) 次]明显增加,差异具有统计学意义(P<0.05),表明侧脑室注射Apelin-13改善了MCAO模型大鼠的学习记忆功能。见图 4。
|
图 4 Apelin-13对MCAO大鼠模型学习记忆功能的影响 注:3组间比较,F=59.19,P<0.05(逃避潜伏期);3组间比较,F=49.74,P<0.05(穿台次数);与假手术组相比较,*P<0.05,n=6;与MCAO模型大鼠相比较,#P<0.05,n=6 |
手术30d后,MCAO模型组大鼠海马组织BDNF表达明显低于假手术组大鼠,差异具有统计学意义(P<0.05),而Apelin-13干预组大鼠海马组织BDNF表达高于MCAO模型组大鼠,差异具有统计学意义(P<0.05);而Rho A与之相反,MCAO模型组大鼠海马组织Rho A表达高于假手术组大鼠,差异具有统计学意义(P<0.05),而Apelin-13干预组大鼠海马组织Rho A表达低于MCAO模型组大鼠,差异具有统计学意义(P<0.05)。见图 5。

|
图 5 Apelin-13对MCAO大鼠模型BDNF和RhoA表达的影响 注:3组间比较,F=93.23,P<0.05(BDNF);3组间比较,F=69.54,P<0.05(RhoA);与假手术组相比较,*P<0.05,n=6;与MCAO模型大鼠相比较,#P<0.05,n=6 |
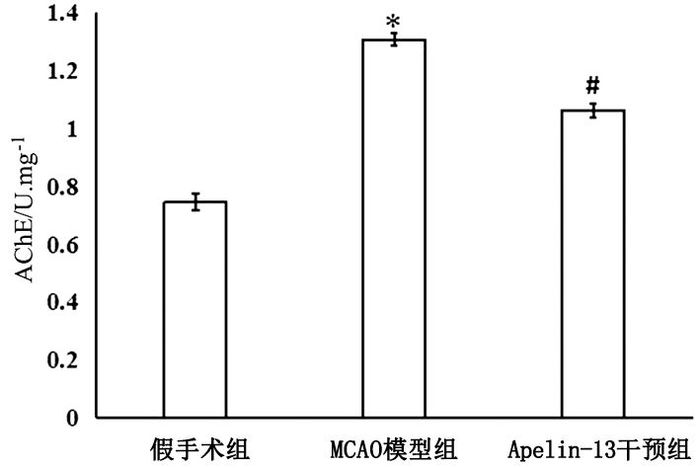
手术30d后,MCAO模型组大鼠海马组织AChE活性[(0.746±0.028) U/mg]明显高于假手术组大鼠[(1.307±0.021) U/mg],差异具有统计学意义(P<0.05);而Apelin-13干预组大鼠海马组织AChE活性[(1.062±0.024) U/mg]明显低于MCAO模型组大鼠,差异具有统计学意义(P<0.05)。见图 6。
|
图 6 Apelin-13对MCAO大鼠模型AChE活性的影响 注:3组间比较,F=119.57,P<0.05(AChE);与假手术组相比较,*P<0.05,n=6;与MCAO模型大鼠相比较,#P<0.05,n=6 |
缺血性脑中风患者常伴有行为和认知功能障碍,严重降低了生活质量,而海马结构在其中具有重要作用。因此,提高缺血性脑中风的行为和认知功能对改善患者的生活质量意义重大。MCAO导致的缺血性脑卒中引起了行为学和认知功能障碍,降低了患者的生活质量。MCAO大鼠脑缺血-再灌注模型也证实,大鼠运动和认知功能均受损。Apelin-13具有神经保护作用,抑制了急慢性损伤引起的神经元凋亡。本实验利用改进的Longa方法制作的MCAO缺血-再灌注模型引起了行为学和认知功能障碍,侧脑室注射Apelin-13改善了大鼠的运动功能,提高了认知能力。
海马是大脑边缘系统的重要结构,在认知功能中起关键作用。MCAO引起了海马神经元的损伤,导致学习和记忆功能下降。神经营养因子BDNF在脑组织中含量丰富,主要分布于海马和皮质。BDNF与其受体酪氨酸激酶受体B(tyrosine kinase B, Trk B)结合后,激活下游丝裂原活化蛋白激酶/细胞外信号调节激酶、磷脂酶和磷脂酰肌醇3激酶等信号通路,从而提高海马突触可塑性,促进神经元存活和损伤神经元修复,增强学习记忆等认知功能[8]。BDNF合成缺陷和功能异常是认知功能下降的主要原因之一,基因敲除BDNF降低了大鼠的学习记忆能力[9],而外源性BDNF抑制了缺血引起的神经元损伤,提高了认知功能[10]。本实验表明侧脑室注射Apelin-13升高了MCAO大鼠缺血-再灌注模型海马组织BDNF表达,降低了逃避潜伏期,穿台次数增加,表明学习记忆功能增强。因此,BDNF可能参与了缺血性脑卒中Apelin-13对认知功能的改善。
RhoA蛋白是Rho蛋白家族的成员,具有GTP酶活性,可与GTP结合,能够激活下游靶蛋白Rho激酶(Rho-kinase,ROCK)。ROCK是丝氨酸/苏氨酸激酶成员之一,通过磷酸化肌球蛋白轻链,使突触前和突触后的细胞骨架蛋白即肌动蛋白解聚,抑制了中枢神经系统损伤后轴突出芽和生长,缩短了树突长度,在突触重塑中起关键作用[11-12],而海马突触结构重塑与学习记忆密切相关[13]。研究表明,大鼠脑缺血-再灌注后, 缺血海马组织RhoA表达升高,而抑制RhoA表达可明显改善缺血大鼠认知功能,增强了学习记忆功能[3, 14]。因此,RhoA在脑缺血后认知功能的恢复中起重要作用。侧脑室注射Apelin-13抑制了MCAO大鼠缺血-再灌注模型海马组织导致的RhoA升高,从而促进海马神经元突触重塑,这可能与Apelin-13对缺血性脑卒中大鼠模型认知功能改善有关。
海马组织内ACh是促进学习记忆的神经递质,由胆碱能神经元合成储存在囊泡中,对大脑认知功能具有重要作用。ACh由囊泡释放后立刻被AChE水解成胆碱失活,影响突触传递和学习记忆活动,在大鼠脑缺血海马组织中,ACh水平下降,导致认知功能障碍[15]。AChE是乙酰胆碱分解的关键酶,主要分布在海马、额叶和顶叶,抑制AChE活性能够升高ACh水平可以改善认知功能[16]。临床上,AChE抑制剂在临床上提高认知功能效果最好的药物,降低突触间隙AChE活性,增加ACh在突触间隙的浓度,从而发挥治疗作用[17]。本实验结果表明,MCAO模型大鼠海马组织中AChE活性升高,侧脑室注射Apelin-13降低MCAO模型大鼠AChE活性,从而增加ACh的浓度,改善了大鼠在Morris水迷宫中的认知功能。因此,AChE活性参与了Apelin-13对缺血性脑卒中认知功能的调节。
本实验研究结果显示:Apelin-13上调了脑缺血-再灌注损伤海马组织BDNF的表达,而抑制了RhoA和AChE活性的上调,从而改善了行为学和认知功能,为缺血性脑卒中的治疗提供了新的思路。
| [1] | Zhang B, Li F, Zhao W, et al. Protective effects of allicin against ischemic stroke in a rat model of middle cerebral artery occlusion[J]. Mol Med Rep, 2015, 12(3): 3734–3738. DOI:10.3892/mmr.2015.3883 |
| [2] | Taliyan R, Ramagiri S. Delayed neuroprotection against cerebral ischemia reperfusion injury:putative role of BDNF and GSK-3β[J]. J Recept Signal Transduct Res, 2016, 36(4): 402–410. DOI:10.3109/10799893.2015.1108338 |
| [3] | 张燕虹, 李长清, 牛陵川. 精氨酸酶Ⅰ参与环腺苷酸促进脑缺血再灌注大鼠的轴突再生[J]. 中国生物化学与分子生物学报, 2014, 30(4): 369–376. |
| [4] | Kaur J, Sharma S, Sandhu M, et al. Neurokinin-1 receptor inhibition reverses ischaemic brain injury and dementia in bilateral common carotid artery occluded rats:possible mechanisms[J]. Inflammopharmacology, 2016, 24(4): 133–143. DOI:10.1007/s10787-016-0271-6 |
| [5] | Yan XG, Cheng BH, Wang X, et al. Lateral intracerebroventricular injection of Apelin-13 inhibits apoptosis after cerebral ischemia/reperfusion injury[J]. Neural Regen Res, 2015, 10(5): 766–771. DOI:10.4103/1673-5374.157243 |
| [6] | Xin Q, Cheng B, Pan Y, et al. Neuroprotective effects of apelin-13 on experimental ischemic stroke through suppression of inflammation[J]. Peptides, 2015, 63: 55–62. DOI:10.1016/j.peptides.2014.09.016 |
| [7] | 闫晓鸽, 丁良才, 王春梅, 等. Apelin-13对脑缺血再灌注大鼠行为学及脑内YAP蛋白表达的影响[J]. 中华行为医学与脑科学杂志, 2015, 24(10): 882–884. DOI:10.3760/cma.j.issn.1674-6554.2015.10.005 |
| [8] | Lu B, Nagappan G, Lu Y. BDNF and synaptic plasticity, cognitive function, and dysfunction[J]. Handb Exp Pharmacol, 2014, 220: 223–250. DOI:10.1007/978-3-642-45106-5_9 |
| [9] | Lu B, Nagappan G, Lu Y. BDNF and synaptic plasticity, cognitive function, and dysfunction[J]. Handb Exp Pharmacol, 2014, 220: 223–250. DOI:10.1007/978-3-642-45106-5_9 |
| [10] | Harris NM, Ritzel R, Mancini NS, et al. Nano-particle delivery of brain derived neurotrophic factor after focal cerebral ischemia reduces tissue injury and enhances behavioral recovery[J]. Pharmacol Biochem Behav, 2016, 150-151: 48–56. DOI:10.1016/j.pbb.2016.09.003 |
| [11] | Labandeira-Garcia JL, Rodríguez-Perez AI, Villar-Cheda B, et al. Rho Kinase and dopaminergic degeneration:a promising therapeutic target for Parkinson's disease[J]. Neuroscientist, 2015, 21(6): 616–629. DOI:10.1177/1073858414554954 |
| [12] | Ding Y, Lu L, Xuan C, et al. Di-n-butyl phthalate exposure negatively influences structural and functional neuroplasticity via Rho-GTPase signaling pathways[J]. Food Chem Toxicol, 2017, 105: 34–43. DOI:10.1016/j.fct.2017.03.057 |
| [13] | Constans A, Pin-Barre C, Temprado JJ, et al. Influence of aerobic training and combinations of interventions on cognition and neuroplasticity after stroke[J]. Front Aging Neurosci, 2016, 8: 164. DOI:10.3389/fnagi.2016.00164 |
| [14] | Posada-Duque RA, Barreto GE, Cardona-Gomez GP. Protection after stroke:cellular effectors of neurovascular unit integrity[J]. Front Cell Neurosci, 2014, 8: 231. DOI:10.3389/fncel.2014.00231 |
| [15] | Zhang H, Lai Q, Li Y, et al. Learning and memory improvement and neuroprotection of Gardenia jasminoides (Fructus gardenia) extract on ischemic brain injury rats[J]. J Ethnopharmacol, 2017, 196: 225–235. DOI:10.1016/j.jep.2016.11.042 |
| [16] | Liu JM, Wu PF, Rao J, et al. ST09, a novel thioester derivative of tacrine, alleviates cognitive deficits and enhances glucose metabolism in vascular dementia rats[J]. CNS Neurosci Ther, 2016, 22(3): 220–229. DOI:10.1111/cns.12495 |
| [17] | Li Y, Hai S, Zhou Y, et al. Cholinesterase inhibitors for rarer dementias associated with neurological conditions[J]. Cochrane Database Syst Rev, 2015(3): CD009444. DOI:10.1002/14651858.CD009444.pub3 |



