2. 济宁医学院附属济宁市第一人民医院, 济宁 272011;
3. 济宁医学院基础医学院, 济宁 272067;
4. 潍坊医学院, 潍坊 261053
2. Jining First People's Hospital & the Affiliated Hospital of Jining Medical University, Jining 272011;
3. School of Basic Medicine, Jining Medical University, Jining 272067;
4. Weifang Medical University, Weifang 261061, China
肌萎缩脊髓侧索硬化症(amyotrophic lateral sclerosis, ALS)又称运动神经元病(MND)或卢伽雷氏(Lou Gehrig)病,是一种主要累及上下运动神经元的慢性神经退行性疾病[1]。临床表现为骨骼肌进行性萎缩,最终导致瘫痪甚至死亡[2]。关于ALS的发病原因存在多种假说,但均无法完全解释ALS的发病机制[3-4]。调查显示,约5%~10%ALS患者具有家族遗传性,绝大部分为散发性[5]。研究表明,约20%家族性ALS病人超氧化物歧化酶1(superoxide dismutasel, SOD1) 基因有突变。Rosen[6]和Marx[7]等通过G93A突变构建了SOD1G93A ALS转基因鼠,其表现型与人类ALS非常相似,是研究ALS发病机制的理想模型。
bHLH(basic Helix-Loop-Helix)信号通路在各类真核生物的生长发育调控过程中发挥着重要的作用,该信号通路中的因子均含bHLH(碱性螺旋-环-螺旋)基序[8]。分别介入调控神经元生成、肠组织发育、肌细胞生成等生物学过程[9]。NeuroD1是一种神经细胞分化因子,属于激活型bHLH因子,其在神经干细胞定向分化过程当中起关键作用[10]。本实验采用成年SOD1G93A转基因模型鼠,采用免疫荧光、RT-PCR和Western blot技术检测NeuroD1在脊髓内的表达情况,探究ALS的发病机制,为ALS的临床治疗提供一定的理论依据。
1 材料与方法 1.1 实验动物和标本制备Jackson Laboratories (Bar Harbor, Maine)提供表达SOD1G93A突变基因的ALS转基因小鼠。将30d龄ALS雌鼠与正常一月龄雄鼠按1 :2合笼。雌鼠生产后,将生后1月的新生鼠剪取鼠尾,进行DNA检测,鉴定野生型鼠和转基因鼠。将小鼠分成野生型鼠组(WT组)和转基因鼠组(ALS组),每组18只,每组小鼠再随机分为3组:95d组、108d组、122d组,每组6只,分别于95d龄(发病初期)、108d龄(发病中期)和122d龄(发病晚期)处死动物、分离脊髓。部分脊髓标本置于4%多聚甲醛中固定2d以上,30%蔗糖沉底过夜,将脊髓沿水平面切片,以OCT包埋剂包埋,做冰冻切片(厚10μm),用于免疫荧光技术检测。部分脊髓标本提取RNA和蛋白,用于RT-PCR及Western blot检测。
1.2 主要试剂鼠抗NeuroD1多克隆抗体购自Abcam公司;鸡抗β-tubulinIII多克隆抗体;鸡抗GFAP多克隆抗体购自购自Abcam公司;β-actin购自Cell signaling公司;兔抗羊IgG购自武汉凌飞科技有限公司;Trizol购自Sigma公司;NeuroD1和β-actin引物由上海生工生物工程有限公司合成。NeuroD1上游:GGAGGAGGAGGAAGATGAGG、NeuroD1下游:TGGGTCTTGGAGTAGCAAGG,扩增片段长度248bp。β-actin上游:GTCGTACCACAGGCATTGTGATGG、β-actin下游:GCAATGCCTGGGTACATGGTGG,扩增片段长度492bp。
1.3 免疫荧光染色冰冻切片室温复温20min,PBS漂洗干净;加羊血清,37℃温箱放置30min;去除血清,滴加羊抗NeuroD1抗体(1 :50),4℃孵育过夜;PBS漂洗3次,每次5min,滴加兔抗羊IgG(1 :100),37℃避光孵育40min;PBS漂洗。滴加Hoechst 33258(10μg/ml),37℃避光孵育30min;PBS漂洗,封片照相。对照组用0.01M PBS取代一抗,其他相同。利用IPP 5.1图像分析软件分别测量连续免疫荧光图片NeuroD1阳性细胞累积光密度(integrated optical density, IOD)值并进行分析。
为了确定NeuroD1的表达及定位,用抗NeuroD1多克隆抗体与神经元特异性标记物β-tubulinⅢ或星形胶质细胞特异性标记物GFAP,作免疫荧光双标染色,步骤如下:将冰冻切片室温复温20min,用PBS漂洗干净;加羊血清,37℃孵育30min;去除血清,加鼠抗NeuroD1多克隆抗体与鸡抗GFAP多克隆抗体或鸡抗β-tubulinIII多克隆抗体,4℃孵育过夜;37℃温箱复温30 min,PBS漂洗3次,每次5min;滴加FITC标记的鼠抗羊IgG(1 :500)、cy3标记的兔抗鼠IgG(1 :500) 与DyLight 488标记的羊抗鸡IgY(1 :500) 的混合二抗或滴加FITC标记的鼠抗羊IgG(1 :500)、cy3标记的兔抗鼠IgG (1 :500) 的混合二抗,37℃避光孵育50min;PBS漂洗3次,每次5min;滴加Hoechst 33258(10μg/ml),37℃避光孵育30min;PBS漂洗3次,每次5min;以碳酸盐甘油缓冲液封片,荧光显微镜或激光扫描共聚焦显微镜观察、拍照;对照组以PBS取代一抗,其余相同。
1.4 RNA提取及RT-PCR检测Trizol一步法提取总RNA,紫外测光密度(OD)值进行定量,并鉴定RNA的质量;按照试剂盒说明逆转RNA,逆转录条件:37℃ 90min,95℃ 5min;以逆转录产物1μl为模板,加Taq酶20μl,NeuroD1上游引物、NeuroD1下游引物各1μl,β-actin上游引物、β-actin下游引物各1μl,加无菌DDW至40μl,反应条件:94℃ 3min预变性,94℃ 30s变性、60℃ 30s退火和72℃ 30s延伸依次循环30次,最后一个循环延伸72℃ 5min。测量RT-PCR显示的NeuroD1 mRNA扩增带IOD与β-actin扩增带IOD的值,并进行比值计算、分析。
1.5 Western blot检测将取出的脊髓放入研磨器中,加入细胞裂解液,转移到离心管中,超声粉碎(10s/3次),冰浴30min;4℃、1200转/min离心15min,取上清;取120μg蛋白进行电泳;90V恒压将蛋白转至NC膜;5%脱脂奶粉/PBS封闭1h;兔抗sFRP4多克隆抗体(1 :1000) 或小鼠抗β-actin单克隆抗体(1 :10000),4℃孵育过夜;5%脱脂奶粉/ PBS漂洗3次,每次10min;加羊抗兔IgG(1:10000) 或兔抗小鼠IgG(1 :10000),室温孵育2h;全自动化学发光成像系统(Bio-Rad XRP+)检测。
1.6 统计学方法采用SPSS18.0统计软件对结果进行分析。
2 结果 2.1 脊髓NeuroD1阳性细胞的变化NeuroD1免疫荧光结果显示,在95、108、122d的ALS转基因鼠和同窝野生型鼠脊髓的灰质前角可检测到NeuroD1阳性细胞。与同窝野生型鼠比较,ALS转基因鼠脊髓前角NeuroD1阳性细胞光密度值降低,差异具有统计学意义。见图 1、表 1。

|
图 1 95、108、122d龄小鼠脊髓灰质前角NeuroD1阳性细胞染色情况(免疫荧光染色,×400) 注:A1、B1、C1分别为95、108、122d转基因鼠脊髓灰质前角NeuroD1阳性细胞染色情况;A2、B2、C2分别为A1、B1、C1与Hoechst33258染细胞核合成图;A3、B3、C3分别为95、108、122d野生型鼠脊髓灰质前角NeuroD1阳性细胞染色情况;A4、B4、C4分别为A3、B3、C3与Hoechst33258染细胞核合成图 |
| 表 1 不同时间点NeuroD1阳性细胞光密度值 |
免疫荧光双标染色结果显示,大量NeuroD1与β-tubulin Ⅲ共表达于同一细胞,提示NeuroD1阳性细胞主要为神经细胞,少量NeuroD1与GFAP共表达。免疫荧光双标结果显示,ALS转基因鼠NeuroD1/β-tubulin Ⅲ双阳性细胞较多,提示NeuroD1促进神经干细胞向神经元方向分化。见图 2。
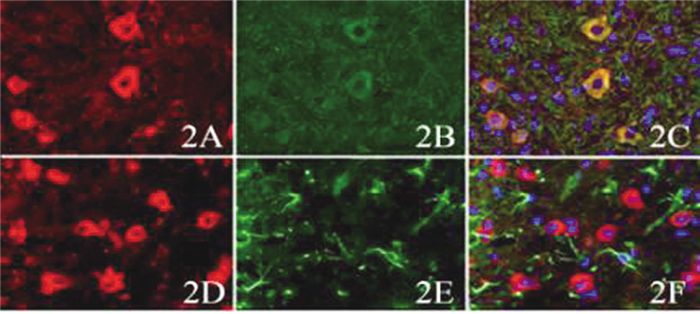
|
图 2 ALS转基因鼠脊髓灰质内NeuroD 1/β-tubulinⅢ和NeuroD 1/GFAP共表达情况(免疫荧光双标染色,×400) 注:2A.免疫荧光双标染色示ALS转基因鼠脊髓灰质内NeuroD 1表达;2B.免疫荧光双标染色示β-tubulinⅢ表达;2C.2A及2B合成图;2D.免疫荧光双标染色示ALS转基因鼠脊髓灰质内NeuroD 1表达;2E.免疫荧光双标染色示GFAP表达;2F.2D及2E合成图 |
RT-PCR结果显示,在ALS转基因鼠与同窝野生型鼠在每个时期均可检测到NeuroD1阳性条带,与同窝野生型鼠相比,转基因鼠NeuroD1 mRNA水平均降低,差异具有统计学意义(t=3.82,P<0.05;t=5.85,P<0.05;t=4.96,P<0.05)。见图 3。
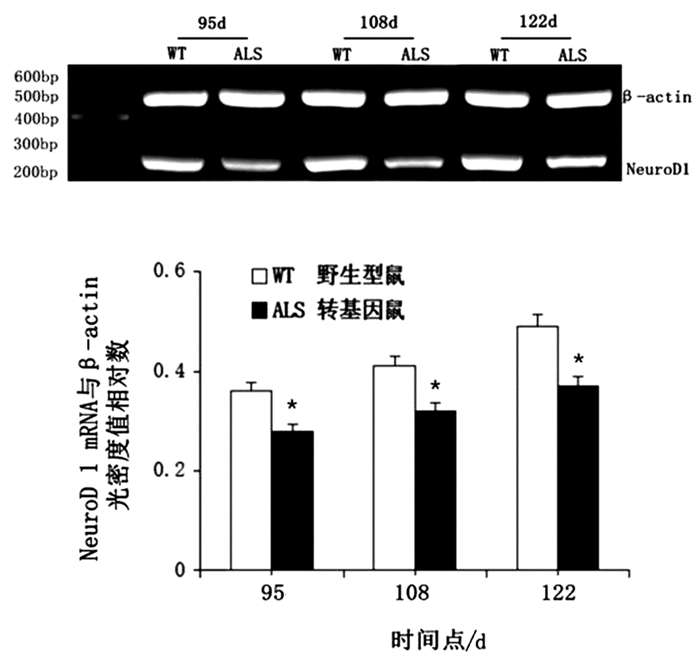
|
图 3 不同时间点NeuroD1 mRNA水平的表达变化 注:与同窝野生型鼠比较*P<0.05 |
Western blot结果显示,NeuroD1在ALS转基因鼠与同窝野生型鼠脊髓中均表达,与同窝野生型鼠相比,转基因鼠NeuroD1蛋白表达均降低,差异具有统计学意义(t=8.49,P<0.05;t=8.74,P<0.05;t=5.94,P<0.05)。见图 4。

|
图 4 不同时间点NeuroD1蛋白水平的表达变化 注:与同窝野生型鼠比较*P<0.05 |
在神经系统发育过程中,bHLH家族转录因子发挥着决定性作用。NeuroD家族属于激活型bHLH因子,包括4个成员,分别是NeuroD1、NeuroD2、NeuroD4和NeuroD6。NeuroD1主要在含有尚未完全分化的神经元的组织中表达,在神经系统中主要的表达时间点有两个,首先是在神经系统的生成过程中表达,继而在分化成熟的神经元中持续表达,如人和小鼠的脊髓、小脑和海马等,在神经干细胞分化过程中起关键作用。实验表明,在非洲蟾蜍或鸡的胚胎中异位表达NeuroD1可引起神经元前体提前分化为神经元,并促使其他干细胞转化为神经元。通过酵母双杂交实验也发现,NeuroD1在神经细胞的发育过程中表达,而且在神经母细胞中过表达该基因时引起神经细胞提前成熟;外源引入该基因,使原本向表皮细胞分化的干细胞发育成神经元细胞。因此,NeuroD1充当一种神经元分化因子,能促使神经干细胞或非神经干细胞分化为神经元。在胚胎发育的早期缺失NeuroD1可导致胚胎不能成熟。在神经退行性疾病中,通常都会出现神经元数目减少和星形胶质细胞反应性增生,这可能与激活型和抑制型bHLH转录因子之间的动态平衡被打乱有关,激活型bHLH转录因子表达下调抑制了神经干细胞向神经元方向分化导致神经元数量的减少,可推动和加剧肌萎缩侧索硬化症、阿尔茨海默病、帕金森病和亨廷顿氏病等多种慢性神经退行性疾病的进展。本课题组前期研究发现,在ALS发病过程中,ALS转基因鼠出现了星形胶质细胞活化,神经元退行性病变导致了胶质细胞反应。星形胶质细胞在ALS发病中通过分泌细胞因子、能量代谢、调节蛋白质和抗氧化损伤等多种途径保护神经元。在ALS转基因鼠发病的95d、108d和122d,脊髓灰质前角都出现神经元细胞减少和星形胶质细胞反应性增生现象,这与本实验结果中NeuroD1表达下调对神经系统的影响一致。
本文结果显示,NeuroD1阳性细胞在95d、108d、122d龄ALS转基因鼠和同窝野生型鼠的脊髓灰质中均可被检测到。在灰质内,大量的NeuroD1阳性细胞位于脊髓前角,主要分布于前角的神经元中,脊髓后角也有表达,但阳性细胞的数量少于前角。与同窝野生型鼠比较,ALS转基因鼠脊髓内NeuroD1阳性细胞的光密度值在95d、108d和122d均减少。免疫荧光双标结果显示NeuroD1与β-tubulin Ⅲ共表达于同一细胞,提示NeuroD1阳性细胞主要为神经细胞。RT-PCR和Western blot结果同样发现,与同窝野生型鼠比较,ALS转基因鼠脊髓内NeuroD1 mRNA和蛋白表达在95d、108d和122d均降低,表明NeuroD1在ALS发病过程中的表达降低。
NeuroD1是重要的bHLH转录因子之一,在人和哺乳动物的神经系统发育和损伤修复的过程中,NeuroD1作为激活型的bHLH因子促进神经元细胞分化,抑制神经胶质细胞分化。本实验结果显示NeuroD1在ALS发生发展过程中的表达均明显减少,在星形胶质细胞中表达少。对神经干细胞分化为神经元的激活作用减弱,对其向神经胶质细胞分化的抑制作用也减弱,同时也抑制了一系列下游bHLH转录因子促进神经细胞分化的作用。因此,推测在ALS转基因鼠发病的脊髓中神经元减少、星形胶质细胞大量增殖与NeuroD1的表达下调有关,导致了ALS转基因鼠脊髓病变的发展。从而得到NeuroD1表达的降低在ALS的发生和发展中起到重要的作用。但是bHLH信号通路在神经退行性疾病发病机制中的作用还有待进一步研究。
| [1] | Couratier P, Corcia P, Lautrette G, et al. ALS and frontotemporal dementia belong to a common disease spectrum[J]. Rev Neurol (Paris), 2017, 173(5): 273–279. DOI:10.1016/j.neurol.2017.04.001 |
| [2] | Mehrpour M, Mohebi N, Motamed MR, et al. Amyotrophic lateral sclerosis as a paraneoplastic manifestation in the neuroendocrine tumor of stomach:a case report[J]. Acta Med Iran, 2013, 51(10): 724–726. |
| [3] | Achsel T, Barabino S, Cozzolino M, et al. The intriguing case of motor neuron disease:ALS and SMA come closer[J]. Biochem Soc Trans, 2013, 41(6): 1593–1597. DOI:10.1042/BST20130142 |
| [4] | Keifer Jr OP, O'Connor DM, Boulis NM. Gene and protein therapies utilizing VEGF for ALS[J]. Pharmacol Ther, 2014, 141(3): 261–271. DOI:10.1016/j.pharmthera.2013.10.009 |
| [5] | Liu ZJ, Lin HX, Liu GL, et al. The investigation of genetic and clinical features in Chinese patients with juvenile amyotrophic lateral sclerosis[J]. Clinical Genetics, 2017. DOI:10.1111/cge.13015 |
| [6] | Rosen DR, Siddique T, Patterson D, et al. Mutations in Cu/Zn superoxide dismutase gene are associated with familial amyotrophic lateral sclerosis[J]. Nature, 1993, 362(6415): 59–62. DOI:10.1038/362059a0 |
| [7] | Marx J. Mouse model found for ALS[J]. Science, 1994, 264(5166): 1663–1664. DOI:10.1126/science.8209242 |
| [8] | Acharya A, Baek ST, Huang G, et al. The bHLH transcription factor Tcf21 is required for lineage-specific EMT of cardiac fibroblast progenitors[J]. Development, 2012, 139(12): 2139–2149. DOI:10.1242/dev.079970 |
| [9] | Ohashi-Ito K, Fukuda H. Functional mechanism of bHLH complexes during early vascular development[J]. Current Opinion in Plant Biology, 2016, 33: 42–47. DOI:10.1016/j.pbi.2016.06.003 |
| [10] | Pataskar A, Jung J, Smialowski P, et al. NeuroD1 reprograms chromatin and transcription factor landscapes to induce the neuronal program[J]. EMBO J, 2016, 35(1): 24–45. DOI:10.15252/embj.201591206 |



