β-羧基乙基锗倍半氧化物(Ge-132) 及其衍生物因具有众多的生物活性和较小的毒副作用而成为有机锗抗癌药物研发的重要内容[1-5],已有的研究结果表明某些Ge-132衍生物表现出较强的抗癌活性[6-8]。结构-活性关系研究显示,有机锗倍半氧化物中的Ge-O-基团发挥关键作用,但引入的功能基团对整体的抗癌活性也有重要影响。在保留有机锗倍半氧化物基本结构的基础上,引入药物活性基团,协同作用的产生而使新化合物具有更好的抗癌活性[5-9]。以杂环类化合物为基本原料合成的抗癌药物已有很多报道,其中柔红霉素(daunomycin)和阿霉素(adriamycin)为主要代表。蒽环类化合物、菲环类化合物,以及氮杂菲环类化合物是目前研究的重要抗癌活性化合物[10-12]。基于上述杂环化合物的重要功能和有机锗倍半氧化物的抗癌活性,我们通过分子设计,保留有机锗倍半氧化物的基本结构,引入菲、氧芴等有机基团,合成了4种含氧芴酰胺或菲酯基团的新型有机锗倍半氧化物,用IR、1HNMR和元素分析确定了它们的组成和结构;用MTT方法检测了4种化合物对体外培养癌细胞人前列腺癌细胞(PC-3M)和人白血病癌细胞(K562) 的抑制作用,探讨了4种化合物的分子结构与抗癌活性关系,取得了一些有意义的研究结果。
1 材料和方法 1.1 材料所有化学试剂均购自国药集团化学试剂有限公司。溶剂在使用前均经过干燥处理。
PC-3M、K562和胎牛血清购自上海素尔生物科技有限公司;IMDM培养基(Gibco)购自上海北诺生物科技有限公司。
1.2 方法 1.2.1 4种化合物的合成路线4种新型有机锗化合物(4a, 4b, 5a和5b)的合成路线见图 1。首先按文献方法合成三氯锗基丙酰氯(1),Cl3GeCH2CHRCOCl (R=H, CH3)[7]。1与3-胺基-2-甲氧基氧芴反应得中间产物2,1与9-菲酚反应得中间产物3,2和3分别水解便得到最终产物4和5。
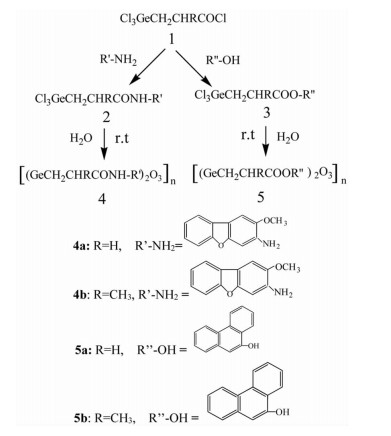
|
图 1 4种化合物的合成路线 |
所有化合物的红外光谱(IR,νcm-1)在BIO-RAD FTS 135上完成,KBr压片;核磁共振谱(1H NMR,δppm)由Bruker Avance 600 MHz测定,DMSO-d6为溶剂,TMS为内标;元属分析(C,N,O)由Vario EL测定,Ge含量用化学分析法测定; 熔点由Büchi B-540测出。
1)β-(N-3-甲氧基-2-氧芴)-酰胺基-乙基锗倍半氧化物的合成(4a)室温搅拌下,向含0.005mol 3-胺基-2-甲氧基氧芴的30ml三氯甲烷溶液中滴加含0.005mol三氯锗基丙酰氯的三氯甲烷溶液25ml和1.5ml三乙基胺,升温至40℃~50℃,氮气保护下搅拌反应4h,产生大量棕色沉淀,过滤,滤液旋转蒸发得黏稠状剩余物,用乙醚洗涤后,加10ml丙酮溶解,丙酮溶液快速搅拌于滴加至50ml蒸馏水中,产生浅黄色沉淀,继续搅拌2h,滤集沉淀,依次用蒸馏水、乙醇、乙醚洗涤,60℃真空干燥2h,得产品(4a)。收率:55%, 熔点:172℃~174℃。IR:1679 (s, -CO-N-),866 (s, Ge-O),572 (m, Ge-C), 3053(m, =C-H), 1516(ms, -C=C-), 1424(m, -C-N-), 3412(s, -N-H-)。1HNMR (DMSO-d6),δ:1.49 (t,2H, -CH2); 2.76(t, 2H,-CH2-); 3.86 (s, 3H, -OCH3); 7.2-8.4(m,6H,HAr), 9.2(s, 1H, -CO-NH-)。元素分析:按C32H28N2O9Ge2 (M=729.21) 计算值,C 52.66, H 3.84, N 3.84, Ge 19.91;实测值,C 52.42;H 3.63;N 4.01;Ge 20.18。
2)β-(N-3-甲氧基-2-氧芴)-酰胺基-β-甲基-乙基锗倍半氧化物的合成(4b)用α-甲基三氯锗基丙酰氯代替三氯锗基丙酰氯,重复以上合成操作,得产品(4b)。收率:41%, 熔点:147℃~150℃。IR:1684(s, -CO-N-),863 (s, Ge-O),530 (m, Ge-C), 3057(m, =C-H), 1513(ms, -C=C-), 1424(m, -C-N-), 3420(s, -N-H-)。1HNMR (DMSO-d6),δ:1.14 (b,3H, -CH3); 1.23-1.50 (db, 2H,-CH2-); 3.0-3.1(m, 1H, -CHCO-); 3.9(s, 3H, -OCH3); 7.3-8.3(m,6H,HAr), 9.14(s, 1H, -CO-NH-)。元素分析:按C34H32N2O9Ge2(M=757.84) 计算值,C 53.84, H 4.22, N 3.69, Ge 19.16;实测值,C 53.63;H 4.11;N 3.80;Ge 18.93。
3)β-(9-菲)-酯基-乙基锗倍半氧化物的合成(5a)室温下,于0.01mol 9-菲酚的40ml三氯甲烷溶液中滴加含0.01mol三氯锗基丙酰氯的三氯甲烷溶液20ml和1.5ml三乙基胺,搅拌1h后升温至40℃,氮气保护下继续搅拌反应3h,产生大量白色沉淀,过滤,滤液旋转蒸发得红棕色黏稠物,用20~30ml乙醚洗涤,加20ml丙酮溶解,快速搅拌下将丙酮溶液滴加至70ml蒸馏水中,产生红棕色沉淀,继续搅拌2h,滤集沉淀,依次用蒸馏水、乙醇、丙酮、乙醚洗涤,60℃真空干燥2h,得产品(5a)。产率:76%;熔点:162℃~165℃。IR:1758 (vs, -CO-O-),1222(s,C-O-C), 883 and 811 (s, Ge-O),510 (m, Ge-C), 3074(m, =C-H), 1633、1604、1498 (ms, -C=C-)。1HNMR (DMSO-d6),δ:1.51 (t,2H, -CH2); 2.68(t, 2H,-CH2-); 6.7-7.8(m,9H,HAr)。元素分析:按C34H26O7Ge2 (M=691.32) 计算,C 59.02, H 3.76, Ge 21.00;实测值,C 58.83;H 3.95;Ge 21.26。
4)β-(9-菲)-酯基-β-甲基-乙基锗倍半氧化物的合成(5b)用α-甲基三氯锗基丙酰氯代替三氯锗基丙酰氯,重复上述合成操作,得产品(5b)。产率:58%;熔点:173℃~175℃.IR:1755 (vs, -CO-O-),1220(s,C-O-C), 886(s, Ge-O),508 (m, Ge-C), 3075(m, =C-H), 1633、1603、1498 (ms, -C=C-)。1HNMR (DMSO-d6),δ:1.21 (b,3H, -CH3); 1.42-1.67(db, 2H,-CH2-); 2.8(m, 1H, -CHCO-); 6.6-7.8(m,9H,HAr)。元素分析:按C36H30O7Ge2 (M=719.53) 计算值,C 60.04, H 4.17, Ge 20.18;实测值,C 59.76;H 3.98;Ge 20.37。
1.2.2 细胞培养及4种化合物对PC-3M和K562细胞的抑制作用观察应用MTT法研究化合物对肿瘤细胞株的抑制作用。实验用细胞为人前列腺癌细胞(PC-3M)和人白血病癌细胞(K562),所用化合物为4a,4b,5a和5b。化合物首先溶解于二甲基亚砜(DMSO)中,根据需要于2h前用培养液稀释到所需的浓度。
将PC-3M细胞接种于培养瓶中,用含10%胎牛血清的IMDM培养基(Gibco)在37℃,5%CO2的培养箱中培养。取生长良好的PC-3M细胞,稀释成2×106个细胞/ml,接种于96孔培养版,每孔100μl,置于37℃,5%CO2的培养箱中培养,24h后,每孔加入不同浓度的有机锗化合物(分别为4a,4b,5a和5b)100μl(用IMDM稀释),使最终浓度分别为5, 15, 30, 60, 120, 和250μmol/L。继续培养48h,弃去上清液收集细胞,每孔加MTT(5.0mg/ml)溶液20μl,置孵箱中培养4h,弃掉上清液,每孔加酸化异丙醇200μl终止反应。置酶标仪(Labsystem)中测定570nm波长的吸光度(A)。每个样品重复3次,取平均值。以不加化合物、其他条件同实验组的为对照组。K562细胞组实验按照PC-3M细胞组相同的方法进行。
根据下式计算化合物对癌细胞的抑制百分率:
抑制率%=(对照组A均值-实验组A均值)/对照组A均值×100%
利用Origin 7.5软件将化合物的抑制率%与化合物的浓度进行S曲线拟合,计算相应化合物的IC50值。
1.3 统计学方法采用SPSS 20.0统计软件进行统计学分析。
2 结果 2.1 化合物的结构4a,4b,5a和5b对两种癌细胞均表现出较强的抑制作用,对PC-3M的IC50分别为10.6, 20.8, 7.4和12.5μmol/L, 对K562的IC50分别为8.5, 15.6, 5.7和9.8μmol/L。4种新型有机锗倍半氧化物IR光谱共同的特点是800~900cm-1均出现强Ge-O振动吸收峰,为-Ge-O-Ge-O-Ge-O-聚合网络结构的基本特征[13],说明新合成的有机锗化合物具有同Ge-132相似的空间结构,基本骨架仍有Ge-O环构成,结构简式为(GeCH2 CHRCOOR’)2O3或(GeCH2CHR CONHR”)2O3。
2.2 4种化合物对体外培养癌细胞的抑制作用 2.2.1 抑癌作用结果比较化合物4a,4b和5b对K562的抑制作用明显高于PC-3M (P<0.05),化合物5a对2种肿瘤细胞株的抑制作用无明显差异(P>0.05),说明所有酰胺类有机锗化合物对2种癌细胞具有显著的识别作用。见表 1。
| 表 1 4种化合物对体外培养肿瘤细胞的抑制作用结果比较(x±s) |
不含甲基的酯类有机锗化合物(5a)对癌细胞没有明显的识别差异,而含甲基的酯类有机锗化合物(5b)对癌细胞则有显著的识别差异。对2种肿瘤细胞株,不含甲基基团的化合物(4a和5a)比含甲基的化合物(4b和5b)均具有更强的抑癌活性(P<0.05),说明有机链中甲基的存在不利于抗癌活性的发挥,这与文献[7]一致,同时也预示上述化合物可能与喹啉有机锗相似,与DNA也具有插入方式的结合作用,甲基基团对有机锗药物小分子与DNA的插入结合具有一定的空间阻碍作用。见表 2。
| 表 2 甲基基团对体外培养PC-3M和K562细胞的抑制作用结果比较(x±s) |
菲酯有机锗类化合物(5a和5b)的IC50明显低于相应的氧芴酰胺有机锗类化合物(4a和4b)(P<0.05),说明酯类化合物比酰胺类化合物具有更强的抑癌作用。很可能是有机锗酯类化合物比有机锗酰胺类化合物对DNA具有更强的结合作用。见表 3。
| 表 3 菲酯有机锗与氧芴酰胺有机锗化合物对体外培养PC-3M细胞的抑制作用结果比较(x±s) |
合成的具有氧芴酰胺或菲酯基团的新型有机锗倍半氧化物能够显著抑制体外培养癌细胞的增殖,甲基的存在不利于抗癌作用的发挥,有机锗酯类化合物抗癌活性更强。这些研究结果对进一步揭示有机锗化合物的结构活性关系、明确抗癌作用机理、设计合成高效低毒的新型抗癌药物提供了重要的参考资料。
| [1] | Thayer JS. Germapharmaca:Some recent studies on biologically active organogermanium compounds[J]. Applied Organometallic Chemistry, 1987, 1(3): 227–234. DOI:10.1002/aoc.590010303 |
| [2] | Rice LM, Wheeler JW, Geschickter CF. Spirans XXⅡ.Synthesis of 4, 4-dialkyl-4-germacyclohexanone and 8, 8-dialkyl-8-germaazaspiro[4.5] decanes[J]. Journal of Heterocyclic Chemistry, 1974, 11(6): 1041–1047. DOI:10.1002/jhet.5570110634 |
| [3] | Ye Y, Zeng Q, Wang QM. Synthesis and crystal structure of O, O-dimethyl-N-(β-triphenyl germanyl) propionyl-α-amino-benzyl phosphonates[J]. Chinese J Struct Chem, 2001, 20(3): 195–198. |
| [4] | 上官国强, 曲晓刚. 有机锗蒽醌酰胺和有机锗萘酚酯倍半氧化物与DNA的相互作用[J]. 济宁医学院学报, 2013, 36(3): 157–161. DOI:10.3969/j.issn.1000-9760.2013.03.002 |
| [5] | Choi S, Oh C, Han J, et al. Synthesis and biological evaluation of water-soluble organogermanium[J]. Eur J Med Chem, 2010, 45(4): 1654–1656. DOI:10.1016/j.ejmech.2009.12.069 |
| [6] | Yang F, Jin H, Pi J, et al. Anti-tumor activity evaluation of novel chrysin-organogermanium(Ⅳ) complex in MCF-7 cells[J]. Bioorg Med Chem Lett, 2013, 23(20): 5544–5551. DOI:10.1016/j.bmcl.2013.08.055 |
| [7] | Shangguan G, Xing F, Qu X, et al. DNA binding specificity and cytotoxicity of novel antitumor agent Ge132 derivatives[J]. Bioorg Med Chem Lett, 2005, 15(12): 2962–2965. DOI:10.1016/j.bmcl.2005.04.053 |
| [8] | Zhang CL, Li TH, Niu SH, et al. Synthesis and Evaluation of Novel Organogermanium Sesquioxides As Antitumor Agents[J]. Bioinorganic Chemistry and Applications, 2009, 2009: 1–8. DOI:10.1155/2009/908625 |
| [9] | Takakusaki K, Kakimoto N, Takeuchi Y, et al. Synthesis of germanium derivatives of uracil and 5-fluorouracil[J]. Tetrahedron Letters, 1983, 24(16): 1707–1710. DOI:10.1016/s0040-4039(00)81750-5 |
| [10] | Arcamone FM. From the pigments of the actinomycetes to third generation antitumor anthracyclines[J]. Biochimie, 1998, 80(3): 201–206. DOI:10.1016/s0300-9084(98)80003-5 |
| [11] | Sami SM, Dorr RT, Solyom AM, et al. Amino-Substituted 2-[2-(Dimethylamino)ethyl]-1, 2-dihydro-3H-dibenz[de, h]isoquinoline-1, 3-diones.Synthesis, Antitumor Activity, and Quantitative Structure-ActivityRelationship[J]. Journal of Medicinal Chemistry, 1995, 38(6): 983–993. DOI:10.1021/jm00006a018 |
| [12] | Sami SM, Dorr RT, Alberts DS, et al. Analogues of amonafide and azonafide with novel ring systems[J]. J Med Chem, 2000, 43(16): 3067–3073. DOI:10.1021/jm9905817 |
| [13] | Tsutsui M, Kakimoto N, Axtell D D, et al. Crystal structure of "carboxyethylgermanium sesquioxide"[J]. Journal of the American Chemical Society, 1976, 98(25): 8287–8289. DOI:10.1021/ja00441a081 |



