蛋白多肽类药物由于其多样性和高度的专属性,在临床上应用于许多重大疾病的治疗[1-4]。然而,由于其蛋白质和大分子的本性,蛋白多肽类药物体内外稳定性差,容易被降解失活,同时跨膜转运困难,使得其在临床使用中存在很多重大问题和挑战[5-7]。原位温敏凝胶给药系统具有多种给药途径和剂型的优点[8-9],有利于保持蛋白多肽类药物局部、长时间、有效。局部给药,能提高局部药物浓度,降低全身毒副作用,患者顺应性好[10-11]。本文以牛血清白蛋白(BSA)为模型药物,采用经典的温敏凝胶材料普朗尼克127为载体,构建蛋白多肽的温敏凝胶局部给药系统,阐明其释放机制,为今后生物大分子药物给药系统新剂型的设计奠定基础,同时为生物制品给药系统的研发提供参考。
1 材料 1.1 主要仪器磁力加热搅拌器(T8-1型,江苏省金坛市荣华仪器制造有限公司);XW-80A微型漩涡混合仪(上海泸西分析仪器厂有限公司);酶标分析仪DNM-9602G(北京普朗新技术有限公司);双光束紫外可见分光光度计(Tu-1901,北京普析通用仪器公司)。
1.2 试剂普朗尼克F127(上海源叶生物科技有限公司);甲醇(分析纯,莱阳经济技术开发区精细化工厂);PBS干粉(北京索莱宝科技有限公司);BCA蛋白定量试剂盒(北京索莱宝科技有限公司)。
2 方法与结果 2.1 BSA含量分析方法的建立 2.1.1 储备液的制备精密量取100μl BSA标准品于2ml的EP管中,加入900μl PBS缓冲液,使终浓度为0.5mg/ml,备用。
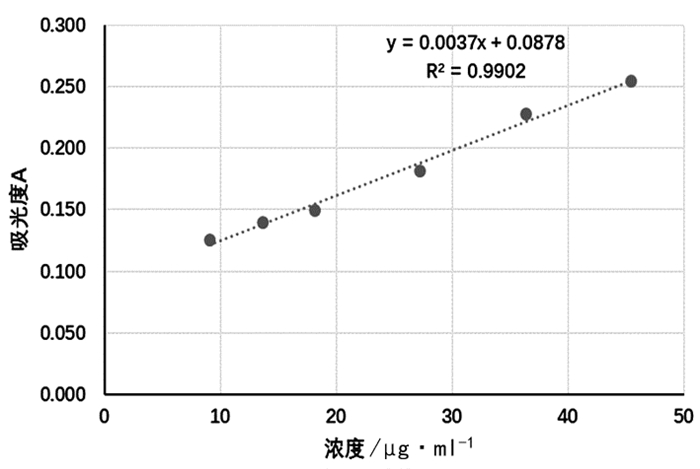
2.1.2 标准曲线的绘制取储备液适量,加入PBS缓冲液稀释为系列浓度的标准品溶液。分别取标准品溶液20μl,加入到96孔板中,然后每孔中加入200μl的工作液(BCA试剂与Cu试剂的体积比为50:1),将孔板置于37℃放置30min,用酶标仪在562nm波长处测定吸光度(表 1)。以吸光度对浓度进行线性回归,得到标准曲线方程A=0.0037C+0.0878,R2=0.9902。见图 1。
| 表 1 BSA标准曲线的绘制 |
|
图 1 BSA浓度-吸光度标准曲线 |
结果表明,BSA在9.09~45.45μg/ml浓度范围内,吸光度与浓度线性关系良好。
2.1.3 精密度精密量取BSA标准品储备液适量,分别以PBS稀释液制备高、中、低浓度标准液,每份标准液各制备6份,于日内(n=3) 和日间(n=3) 测定吸光度。考察日内和日间精密度。日内和日间精密度考察结果。见表 2。
| 表 2 UV-Vis法测定BSA含量的精密度考察(n=6) |
由表可知,日内和日间RSD值均小于2%,重现性良好,符合方法学要求。
2.1.4 加样回收率取BSA标准品储备液适量,加入PBS稀释至浓度为9.09μg/ml的溶液,备用。另取储备液适量,分别以PBS稀释制备高、中、低浓度标准液。
取9.09μg/ml的BSA标准品溶液3份(2ml/份),分别加入高、中、低浓度的标准液1ml,混匀后测定各混合液的吸光度,计算加样后BSA的浓度和加样回收率。结果表明该方法的加样回收率良好。见表 3。
| 表 3 BSA加样回收率的测定(n=3) |
称取0.5g普朗尼克F127,加入2ml冰去离子水,于冰浴中磁力搅拌2h直至溶液呈澄清透明状即得。
2.2.2 BSA-温敏凝胶的制备称取BSA原料药40mg,加入2ml去离子水溶解,在冰浴搅拌下,缓缓加入0.5g的普朗尼克F127颗粒,继续搅拌2h,至完全溶解。迅速将载有BSA的凝胶液置于37℃水浴中,静置10min,即得载有BSA的普朗尼克F127温敏凝胶,置于37℃孵箱中保存备用。
2.3 相变温度的测定本文采用倒置试管法测定相变温度。将普朗尼克F127凝胶置于预设温度的水浴锅中平衡5min,取出后迅速倒置观察其流动性。若流动性良好,使水浴温度升高1℃,平衡10min后,继续上述步骤。直至液体变为凝胶状不再流动,记录此时的温度即为相变温度。
2.3.1 普朗尼克F127浓度对相变温度的影响分别测定15%、20%、25%F127温敏凝胶的相变温度。见表 4。
| 表 4 F127浓度对相变温度的影响 |
由结果可知,普朗尼克F127温敏凝胶的相变温度随浓度升高而降低,在浓度为20%以上时,相变温度降低不明显。文献报道,同时兼顾凝胶的黏度及制备难易程度等因素,最终确定以20%(w/v)作为普朗尼克F127温敏凝胶的最终浓度。
2.3.2 载有BSA温敏凝胶相变温度按照2.2.2项下方法制备BSA温敏凝胶,BSA的浓度为20mg/ml,F127的浓度为20%(w/v),测定载药温敏凝胶的相变温度,结果表明,加入BSA后,温敏凝胶给药系统的相变温度无变化,仍为23℃。
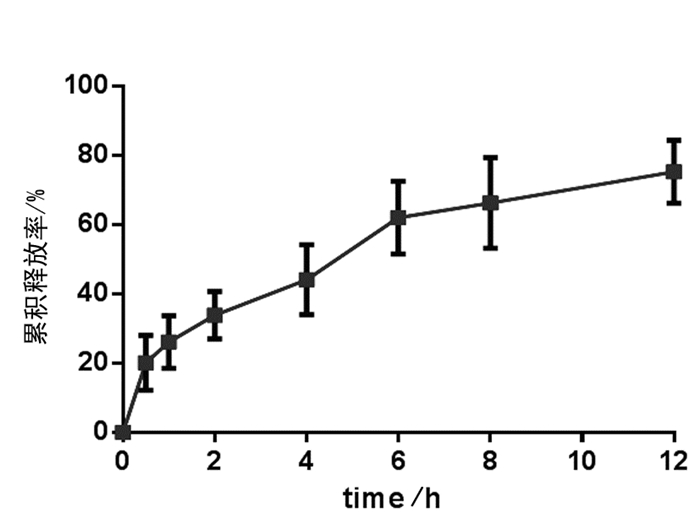
2.4 BSA温敏凝胶释放度的考察按照2.2.2项下方法制备BSA温敏凝胶,在低温下取300μl加入到transwell小皿中。然后将小皿迅速放入已预热至37℃的PBS缓冲液中,缓冲液的体积为15ml。设定恒温振荡器的振荡速率为100rpm,温度为37℃。在预设的时间点,取出释放液,并补充同温下相同体积的新鲜释放液。样品液采用2.1项下BCA法测定蛋白BSA的吸光度,代入标准曲线计算BSA的浓度,换算各时间点下凝胶制剂中释放出的BSA的量。结果如表 5所示。以BSA的累计释放量为纵坐标,释放时间为横坐标作图。见图 2。
| 表 5 BSA-普朗尼克F127温敏凝胶系统释放度考察 |
|
图 2 BSA-普朗尼克F127温敏凝胶给药系统中BSA释放曲线 |
由结果可知,BSA载到普朗尼克F127温敏凝胶系统中后,具有缓释效果。释放时间可长达12h,且整个过程BSA的释放较平缓,接近于零级释放。
3 讨论普朗尼克,又名泊洛沙姆,是一种由聚氧乙烯PEO和聚氧丙烯PPO组成的三嵌段共聚物。其中普朗尼克127(泊洛沙姆407),其形成的水凝胶因具有温度敏感性质且是药用辅料,是目前应用较为经典的温敏凝胶材料。其在低温、低浓度下,F127以单个分子存在;随着温度升高,F127分子中疏水片段PPO脱水,形成内部为疏脱水,形成内部为疏水PPO核心、外部为溶胀的PEO片段的球形胶束。当达到一定温度和足够的浓度时,由于胶束的堆积缠绕形成凝胶。本文即选用该材料作为载体制备BSA温敏凝胶给药系统。
常用的局部给药系统包括药物植入剂、凝胶、薄片、棒和微粒给药系统等。凝胶是溶胶或溶液中的胶体粒子或高分子在一定条件下互相连接,形成的三维空间网状结构,结构空隙中充满了作为分散介质的液体。自从上世纪60年代被用于软性接触镜后,凝胶的使用以惊人的速度增长,现在已经被广泛地应用到药学和生物学领域。近十年来,研究兴趣转移到可注射的原位凝胶上,其形成的机制包括温度敏感性、pH敏感性、光敏感性等等。温度敏感性的凝胶,即原位温敏凝胶,在体外呈现一种溶胶状态,可以包载各种药物。当其被注射进体内后,由于温度的升高,溶胶体系迅速形成半固体的凝胶,从而实现局部缓控释效果。本文制备的BSA-普朗尼克F127温敏凝胶系统,相变温度在23℃,释放时间可达12h,接近于零级释放。
| [1] | Brekke OH, Sandlie I. Therapeutic antibodies for human diseases at the dawn of the twenty-first century[J]. Nat Rev Drug Discov, 2003, 2(1): 52–62. DOI:10.1038/nrd984 |
| [2] | Coelho T, Adams D, Silva A, et al. Safety and efficacy of RNAi therapy for transthyretin amyloidosis[J]. N Engl J Med, 2013, 369(9): 819–829. DOI:10.1056/NEJMoa1208760 |
| [3] | Kim HJ, Kim A, Miyata K, et al. Recent progress in development of siRNA delivery vehicles for cancer therapy[J]. Adv Drug Deliv Rev, 2016, 104: 61–77. DOI:10.1016/j.addr.2016.06.011 |
| [4] | Beck A, Wurch T, Bailly C, et al. Strategies and challenges for the next generation of therapeutic antibodies[J]. Nat Rev Immunol, 2010, 10(5): 345–352. DOI:10.1038/nri2747 |
| [5] | Weiner GJ. Building better monoclonal antibody-based therapeutics[J]. Nat Rev Cancer, 2015, 15(6): 361–370. DOI:10.1038/nrc3930 |
| [6] | Moroz E, Matoori S, Leroux JC. Oral delivery of macromolecular drugs:Where we are after almost 100 years of attempts[J]. Adv Drug Deliv Rev, 2016, 101: 108–121. DOI:10.1016/j.addr.2016.01.010 |
| [7] | Ye M, Kim S, Park K. Issues in long-term protein delivery using biodegradable microparticles[J]. J Control Release, 2010, 146(2): 241–60. DOI:10.1016/j.jconrel.2010.05.011 |
| [8] | Colson YL, Liu R, Southard EB, et al. The performance of expansile nanoparticles in a murine model of peritoneal carcinomatosis[J]. Biomaterials, 2011, 32(3): 832–840. DOI:10.1016/j.biomaterials.2010.09.059 |
| [9] | Kamat AA, Kim TJ, Landen CN, et al. Metronomic chemotherapy enhances the efficacy of antivascular therapy in ovarian cancer[J]. Cancer Res, 2007, 67(1): 281–288. DOI:10.1158/0008-5472.CAN-06-3282 |
| [10] | Vassileva V, Allen CJ, Piquette-Miller M. Effects of sustained and intermittent paclitaxel therapy on tumor repopulation in ovarian cancer[J]. Mol Cancer Ther, 2008, 7(3): 630–637. DOI:10.1158/1535-7163.MCT-07-2117 |
| [11] | Vassileva V, Grant J, De Souza R, et al. Novel biocompatible intraperitoneal drug delivery system increases tolerability and therapeutic efficacy of paclitaxel in a human ovarian cancer xenograft model[J]. Cancer Chemother Pharmacol, 2007, 60(6): 907–914. DOI:10.1007/s00280-007-0449-0 |



