酪氨酸酶是一种含铜的多酚氧化酶,广泛存在于人体及动植物、微生物[1],作为人体黑色素合成的关键代谢酶,与人的皮肤衰老、色素沉着性疾病的发生发展有着密切联系;此外,该酶也影响昆虫伤口愈合以及蔬菜水果的褐变[2]。
天然来源酪氨酸酶抑制剂具有安全、毒副作用低、来源广泛、效果独特等优点。从天然产物中寻找酪氨酸酶抑制成分已成为该领域当前的研究热点[3-5]。桑科植物桑白皮作为一种中医临床常用中药,主要用于治疗伏火郁肺,症见咳嗽痰多,色黄黏稠,咯吐不爽等。近年来,有研究发现其提取物具有良好的清除超氧阴离子自由基能力以及抑制酪氨酸酶能力,提示其在皮肤美白和果蔬保鲜等方面具有潜在的应用价值[6-9]。
本实验拟对桑白皮抑制酪氨酸酶的能力进行系统评价,并初步分离其中起主要作用的活性成分,对将来从桑白皮中分离纯化一些具有潜在实际应用价值的酪氨酸酶抑制成分提供一定的参考。
1 材料与方法 1.1 材料马铃薯(市售); 无水乙醇、甲醇、乙醚、二氯甲烷、正己烷、丙酮、乙酸乙酯(分析纯,天津富宇精细化工公司); 左旋多巴(安耐吉); NaH2PO4、NaH2PO4(分析纯,天津永大化学试剂公司)。
1.2 仪器LC-20AT高效液相色谱仪(日本岛津公司);DNM-9602G酶标分析仪(北京普朗公司);UV-2700型分光光度计(日本岛津公司)。
1.3 方法 1.3.1 酪氨酸酶酶液的制备取马铃薯置于4℃环境下过夜,取出后洗净、切碎,按体积比1:2加入pH=5.6的醋酸钠缓冲液,高速匀浆破碎;纱布过滤,滤液用冷冻离心机10000rpm离心10min,取上清液,加入50%饱和度的硫酸铵沉淀蛋白,4℃放置过夜;10000rpm离心10min,取沉淀,用pH=6.86的PBS溶解,PBS透析12h除去硫酸铵,即得酶液,分装后于-20℃冰箱中储存备用。
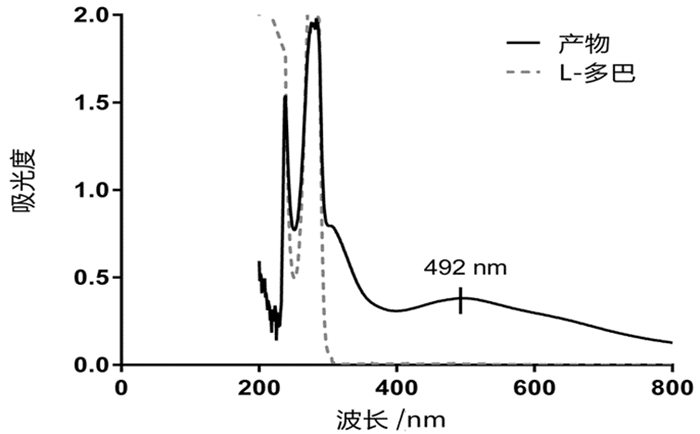
1.3.2 左旋多巴反应产物光谱扫描以1mM左旋多巴溶液为底物,加入适量制备的酶液,置于分光光度计上扫描零时刻反应体系的吸收光谱,30℃下反应30min后再扫描一次体系的吸收光谱,将两次光谱所得吸光度数据相减,得反应始末吸光度的差值,此差值即为反应产物的吸收,从而确定其可用于定量的最大吸收峰的位置。
1.3.3 不同溶剂对桑白皮提取效果的比较向8支10ml离心管中各加入1g桑白皮粉末,分别加入3ml正己烷、甲醇、乙醇、乙醚、水、丙酮、二氯甲烷、乙酸乙酯,室温超声30min,滤去药粉,得提取液。分别取8种提取液各3μl至1.5ml离心管中,真空干燥后,加入210μl PBS和30μl制备的酶液,充分混匀,然后加入60μl的5mM左旋多巴溶液起始反应,30℃下反应20min后,用酶标仪测量最大吸收波长处的吸光度。以不加提取液组的反应活性为100%,其他各组酶的残余活性用各自吸光度与不加提取液组吸光度的比值表示。
1.3.4 桑白皮对马铃薯褐变的抑制效果的探究由于马铃薯中含有的多酚类物质能在空气中被酪氨酸酶催化氧化变色,为了观察桑白皮提取液减缓多酚氧化过程的能力,进行如下实验:将马铃薯切成大小均一的片状,分别取5mM曲酸溶液和20mM曲酸溶液,95%乙醇和桑白皮乙醇提取液,均匀涂抹在马铃薯切片上,每隔1h观察一次切片的颜色变化并记录。
1.3.5 抑制液浓度与抑制活性的关系将桑白皮提取液用95%乙醇分别稀释2、4、6、8、15、20、50、100倍待用。1.5ml的离心管中加入207μl PBS溶液和30μl酶液,然后加入不同稀释倍数的提取液,每个倍数平行两组,充分混匀后,30℃水浴中反应20min,反应完成后用酶标仪测定其在最大吸收波长处的吸光度,用加左旋多巴一组的吸光度减去对照组的吸光度即为反应吸光度的变化值,根据吸光度变化值与提取液浓度作图可得提取液浓度与抑制活性的关系。
1.3.6 提取液的高效液相色谱分析及流分抑制活性将桑白皮提取液进行高效液相色谱分析,测定条件:洗脱梯度:0.01min,水60%,甲醇40%;7.50min,水10%,甲醇90%;17.50min,水10%,甲醇90%;25.00min,水60%,甲醇40%;色谱柱:Diamonsil C18 (5μm,250mm×4.6mm);柱温:40℃;检测器波长:320nm。采用1.5ml离心管在30min内每隔1min接取一份流分,真空干燥箱中40℃干燥,干燥后,向离心管中加入PBS缓冲液,使粉末溶解,再加入适量酶液,混匀后,加入左旋多巴溶液起始反应,30℃水浴下反应20min,采用酶标仪测量其在最大吸收波长处的吸光度。将不添加提取液组的吸光度减去提取液组的吸光度所得差值再除以不添加提取液组的吸光度得抑制率。
2 结果 2.1 左旋多巴反应产物最大吸收波长的确定通过产物与L-多巴的光谱对照图(图 1)可以看出,加入酶液后反应产物在290nm和492nm处有两个吸收峰,290nm处左旋多巴也有吸收峰,因此,此处的吸收有干扰,而492nm左旋多巴没有吸收,所以选择492nm作为后续酪氨酸酶活性定量实验的测量波长。
|
图 1 左旋多巴反应产物的吸收光谱扫描图 |
通过图 2所示的结果可知,不同提取溶剂提取的桑白皮提取液对酪氨酸酶的抑制效果从强到弱依次为甲醇>乙醇>丙酮>水>乙酸乙酯>二氯甲烷>乙醚>正己烷,水、甲醇、乙醇、丙酮等几种极性较大的溶剂对桑白皮中酪氨酸酶抑制成分具有较好的提取效果。

|
图 2 不同溶剂提取的桑白皮提取液对酪氨酸酶的抑制效果 |
图 3结果显示,桑白皮95%乙醇提取液对马铃薯酪氨酸酶介导的褐变过程的抑制作用比5mM曲酸溶液强,而与20mM曲酸溶液抑制强度相近。随后,将所得褐变过程图片导入Image J软件中,通过软件计算光密度(见表 1),并将所得光密度数值制成折线图,得图 4。

|
图 3 桑白皮提取液对马铃薯切片褐变过程的影响 |
| 表 1 马铃薯切片褐变过程的光密度值 |

|
图 4 马铃薯褐变过程的光密度折线图 |
通过光密度变化图(图 4)可以看出,95%乙醇处理组的马铃薯切片的光密度随时间逐渐增大,而曲酸和桑白皮提取液处理组则对光密度的升高过程具有明显的抑制作用,该结果与图 3观察到的颜色变化结果吻合。
2.4 提取液半数抑制浓度的确定桑白皮乙醇提取液对酪氨酸酶的抑制作用随桑白皮浓度的升高而逐渐上升,浓度较高和浓度较低时其反应速率变化较慢,而在0.16~1.67mg/ml内酶的残余活性随桑白皮浓度变化则较明显,结果表明桑白皮对酪氨酸酶活性的抑制作用呈现很好的剂量依赖性,通过采用Graphpad prism 6.0软件的inhibitor vs.normalized response-Variable slope方程对数据进行非线性拟合,得到酶活力下降一半的抑制剂浓度IC50值为0.6225mg/ml。
2.5 桑白皮提取液的高效液相色谱分析从图 6显示的结果可以看出,保留时间在10~15min时间段内的流分对酪氨酸酶活性的抑制作用较强,抑制率均在20%以上。将酶的残余活性数据与高效液相色谱图进行对比,可以看到在色谱图的14~15min有几个吸收较强的信号峰,但10~13min时间段内几乎没有非常明显的吸收信号,可能是由于这些具有抑制活性的成分不存在紫外吸收。通过该实验可以大致确定桑白皮中对酪氨酸酶抑制活性较强的成分为中等极性,对今后从桑白皮中分离提纯酪氨酸酶抑制成分提供了有效的参考。

|
图 5 桑白皮提取液浓度与酶残余活性的关系图 |

|
图 6 桑白皮提取液高效液相色谱图与不同流分的抑制率 |
酪氨酸酶作为黑色素合成的关键酶,其异常过量表达可导致人体的色素沉着性疾病;在果蔬中是导致褐变的主要酶类。因此,酪氨酸酶抑制剂可以治疗目前常见的色素沉着皮肤病如雀斑、黄褐斑、老年斑。目前,市场上流行的美白化妆品中其增白剂均是酪氨酸酶抑制剂如熊果甙、维生素C衍生物、一些中药提取物[10-12]。
桑白皮作为一种中医临床常用中药材,主要用于伏火郁肺症,见咳嗽痰多,色黄黏稠,咯吐不爽。近年的多项研究发现其提取物具有良好的清除超氧阴离子自由基能力以及抑制酪氨酸酶能力,提示其在皮肤美白和果蔬保鲜等方面具有潜在的应用价值。而大部分文献并没有对提取溶剂进行系统的筛选比较,最常采用的提取溶剂为乙酸乙酯和水[7-8],通过我们不同极性溶剂提取实验发现,这两种溶剂的提取效果要比甲醇和乙醇提取效果弱很多。此外,我们又通过高效液相色谱实验初步确定了桑白皮中中等极性的成分为起酪氨酸酶抑制作用的有效成分,但这些成分中有些不具有明显的紫外吸收,将来的分离纯化工作需要特别注意,以免造成有效成分的丢失。
综上所述,通过对桑白皮抑制酪氨酸酶的能力进行系统评价,并初步分离其中起主要作用的活性成分,对将来从桑白皮中分离纯化一些具有潜在实际应用价值的酪氨酸酶抑制成分提供了一定的参考。
| [1] | 陈清西, 宋康康. 酪氨酸酶的研究进展[J]. 厦门大学学报(自然科学版), 2006, 45(5): 731–737. DOI:10.3321/j.issn:0438-0479.2006.05.033 |
| [2] | 胡泳华, 贾玉龙, 陈清西. 酪氨酸酶抑制剂的应用研究进展[J]. 厦门大学学报(自然科学版), 2016, 55(5): 760–768. DOI:10.6043/j.issn.0438-0479.201603101 |
| [3] | 赵春萌. 酪氨酸酶抑制剂筛选及花椒抗氧化、酪氨酸酶抑制活性研究[D]. 兰州: 兰州理工大学, 2014. http://cdmd.cnki.com.cn/Article/CDMD-10731-1014262719.htm |
| [4] | 毕云枫, 宋凤瑞, 刘志强. 天然酪氨酸酶抑制剂的种类及其对酪氨酸酶抑制作用的研究进展[J]. 吉林大学学报(医学版), 2014, 40(2): 454–459. DOI:10.13481/j.1671-587x.20140247 |
| [5] | 张营, 汪秀平. 桑白皮提取物美白活性部位的初步筛选及制备[J]//第九届中国化妆品学术研讨会. 第九届中国化妆品学术研讨会论文集, 2012. |
| [6] | 张晶. 常用桑科中药酪氨酸酶抑制剂研究[D]. 上海: 华东理工大学, 2010. http://cdmd.cnki.com.cn/Article/CDMD-10251-1011050522.htm |
| [7] | 张晶, 王春丽. 桑白皮水提物美白机制研究[J]. 日用化学工业, 2010, 40(6): 444–447. |
| [8] | 吴爽. 桑提取物对酪氨酸酶的抑制作用研究[D]. 北京: 北京化工大学, 2008. http://cdmd.cnki.com.cn/Article/CDMD-10010-1014450391.htm |
| [9] | 王立军. 白芍及桑白皮中酪氨酸酶抑制剂的筛选及其活性成分的抑制动力学研究[D]. 新建: 塔里木大学, 2016. http://cdmd.cnki.com.cn/Article/CDMD-10757-1016056107.htm |
| [10] | 宋康康, 邱凌, 黄璜, 等. 熊果甙作为化妆品添加剂对酪氨酸酶抑制作用[J]. 厦门大学学报(自然科学版), 2003, 42(6): 791–794. DOI:10.3321/j.issn:0438-0479.2003.06.024 |
| [11] | 王白强, 曾晓军. 酪氨酸酶活性的抑制研究及皮肤美白化妆品的研制[J]. 福建轻纺, 2002(7): 1–6. DOI:10.3969/j.issn.1007-550X.2002.07.001 |
| [12] | 韩强, 林惠芬, 朱玲莉. 几种中药提取物对酪氨酸酶活性的抑制[J]. 香料香精化妆品, 1998, 55(4): 22–24. |



