2. 沈阳药科大学中药学院, 沈阳 110016
2. Shenyang Pharmaceutical University, Shenyang 110016, China
博落回(Macleaya cordata(Willd.)R.Br.)是罂粟科(Papaveraceae)博落回属(Macleaya R.Br.)多年生草本植物。我国长江以南、南岭以北的大部分省区均有分布,生长于海拔150~830m的丘陵或低山林中、灌丛中或草丛间[1]。博落回, 性苦、辛,寒,大毒。散瘀,祛风,解毒,止痛,杀虫,主治一切恶疮,顽廯,湿疹,蛇虫咬伤,跌打肿痛,风湿痹痛等。有报道临床用于治疗滴虫性阴道炎,痔疮合并感染,酒皶鼻等[2]。文献报道,博落回中生物碱有抗肿瘤、抗菌、杀虫等多种药理活性,且博落回是医药、兽药、生物农药原料,是纯天然绿色“三药”产品。本课题组对该植物的乙醇提取物进行了化学成分的研究。从中分离得到11个化合物,其中4个新化合物,命名为(+)-博落回新碱A(1), (-)-博落回新碱A(2), (-)-博落回新碱C(3), (+)-博落回新碱C(4)。7个已知化合物,鉴定为(-)-6-丙酮基二氢血根碱(5), (+)-6-丙酮基二氢血根碱(6), (-)-6-丙酮基二氢白屈菜赤碱(7), (+)-6-丙酮基二氢白屈菜赤碱(8), (±)-6-甲氧基二氢血根碱(9), (±)-6-甲氧基二氢白屈菜赤碱(10), (±)-spallidamine(11)。报道如下。
1 实验仪器与材料 1.1 仪器UV光谱仪:Shimadzu UV-2201 spectrometer(岛津企业管理有限公司,日本)。红外光谱仪:Bruker IFS-55 spectrometer(布鲁克股份公司,德国),KBr压片。ECD:Bio-logic MOS 450 spectropolarimeter(大连华洋分析仪器有限公司,中国)。核磁共振波谱仪:Bruker AVANCE Ⅲ HD NMR spectrometer和Bruker AVANCE-600 NMR spectrometer(布鲁克股份公司,德国),TMS做内标。HRESIMS质谱仪为Bruker micrOTOF-Q mass spectrometer(布鲁克股份公司,德国)。X-射线单晶衍射仪:Gemini E X-ray single crystal diffractometer(安捷伦科技有限公司,美国)。高效液相色谱仪:制备高效液相色谱(Shimadzu)(岛津企业管理有限公司,日本),检测器(ShimadzuSPD-20A UV detector),泵(LC-6AB pump),色谱柱(YMC ODS-A, 5m, 250mm×20mm)。分析高效液相色谱仪:Shimadzu LC-20AB,检测器(DAD detector SPD-20MA)(岛津企业管理有限公司,日本)。手性拆分用色谱柱:Daicel Chiralpak IB,IC(250×4.6mm)。旋光仪:Anton Paar MCP 200 PolarimeterM[安东帕(上海)商贸有限公司,中国]。
1.2 试剂柱色谱用硅胶(200~300目、100~200目)和薄层色谱用硅胶GF254(青岛海洋化工厂);中性氧化铝(200~300目,上海陆都化学试剂厂);ODS柱色谱填料(100 μm, 日本YMC公司);Sephadex LH-20(GE Healthcare)。常规用试剂均为AR级;10%硫酸乙醇溶液、碘化铋钾溶液显色剂均按《中草药有效成分提取分离》方法配制。
1.3 药材博落回药材购于河北省安国药材大市场,经沈阳药科大学中药学院中药资源教研室路金才教授鉴定为罂粟科博落回属植物博落回[Macleaya cordata(Willd.) R.Br.]的地上部分。
2 提取与分离取二氯甲烷萃取物500g,经硅胶柱色谱进行分离,用石油醚-丙酮系统(100:5, 100:10, 100:20, 100:50, 100:100, 0:100, v/v)进行梯度洗脱,得到6个流份Fr.A~F。Fr.A再经硅胶柱色谱进行分离,以石油醚-乙酸乙酯系统(100:0, 100:3, 100:5, 100:8, 100:20, v/v)进行梯度洗脱,得到5个亚流份Fr.A1~A5,Fr.A5经过氧化铝柱色谱,石油醚-乙酸乙酯系统梯度洗脱,得流份MixtureⅠ和Mixture Ⅱ,MixtureⅠ再过Sephadex LH-20柱色谱,以CH2Cl2:MeOH=1:1的溶剂洗脱,重结晶得到化合物5和6的混合物(8.5mg),再经过手性HPLC制备,得到化合物5(0.95mg), 6(0.95mg),重结晶的剩余样品再经硅胶柱色谱,石油醚-乙酸乙酯-丙酮系统梯度洗脱,重结晶(化合物7和8的混合物,9.0mg)后再用手性HPLC制备,得到化合物7(0.97mg), 8(0.97mg)。Fr.D1~Fr.D5剩余部分分别过Sephadex LH-20柱色谱,MeOH或CH2Cl2:MeOH=1:1的溶剂洗脱,流份分别通过TLC,喷改良碘化铋钾试剂检识生物碱,显色为阳性的流份合并在一起,得到生物碱混合物23.9g,该生物碱部分再经过ODS柱色谱。60% MeOH洗脱的Fr.41~45经过制备液相色谱和手性HPLC纯化,得到化合物3(1.8mg),4(1.8mg)。65% MeOH洗脱的Fr.67~77甲醇不溶解的部分过Al2O3柱色谱,石油醚-乙酸乙酯系统梯度洗脱,再过Sephadex LH-20,CH2Cl2:MeOH=1:1的溶剂洗脱,重结晶(化合物1和2的混合物,25mg)纯化后再经过手性液相色谱法制备,得到化合物1(0.8mg), 2(0.8mg)。Fr.E经过硅胶吸附柱色谱,以CH2Cl2-MeOH系统(100:0, 200:1, 100:1, 100:2, v/v)梯度洗脱,得到4个亚流份Fr.E1~E4,Fr.E1再经过ODS柱色谱,MeOH-H2O系统梯度洗脱,制备液相色谱纯化得到化合物11(4.0mg),E1经过Sephadex LH-20,CH2Cl2:MeOH=1:1的溶剂洗脱,重结晶,再经手性HPLC制备,得到化合物9(1.0mg), 10(4.5mg)。
3 结构鉴定 3.1 4个新化合物的结构鉴定本课题组对该植物的乙醇提取物进行了化学成分的研究,从中分离得到11个化合物,其中4个为新化合物和7个已知化合物。化合物1~11化学结构见图 1。
|
图 1 化合物1~11的化学结构 |
化合物1和化合物2:化合物macleayin A为白色粉末。改良碘化铋钾显橘黄色,推测为生物碱类化合物。HRESIMS给出准分子离子峰m/z 701.2489[M+H]+(计算值为701.2494),确定该化合物分子式为C41H36N2O9,其不饱和度为25。紫外光谱中最大吸收峰λmax:230, 288nm。红外光谱(KBr)中给出羰基(1668cm-1)、亚甲二氧基(2792, 939cm-1)和苯环(1619, 1485, 1463cm-1)吸收峰。1H NMR(600MHz, CDCl3)谱中显示有3个AB自旋系统的芳香氢信号δH 7.68(1H, d, J=8.5Hz), 7.46(1H, d, J=8.5Hz), 7.12(1H, d, J=7.9 Hz), 6.57(1H, br s);7.50(1H, br s), 7.07(1H, d, J=8.1Hz), 苯环对位的2个芳香氢信号δH 7.01(1H, s), 6.61(1H, s), 3组亚甲二氧基质子信号δH 6.11(1H, d, J=1.5Hz), 5.95(1H, br s); 5.92(1H, d, J=1.4Hz), 5.90(1H, d, J=1.4Hz); 5.91(1H, d, J=1.2Hz), 5.89(1H, d, J=1.2Hz), 2个甲氧基质子信号δH 3.95(3H, s), 3.46(3H, s)和2个N-CH3质子信号δH 2.49(3H, s), 1.52(3H, s)。13C NMR(100MHz, CDCl3)(表 1)结合HSQC谱显示有40个碳信号,其中有28个芳香碳、3个亚甲二氧基碳δC 101.7, 101.4和100.9,2个甲氧基碳δC 60.9, 56.1,2个N-CH3碳δC 41.6, 40.9,3个亚甲基碳δC 57.3, 48.4, 33.9,2个sp3次甲基碳δC 57.3, 52.7。与苯并菲啶类生物碱比较[3-4],该化合物可能是一个苯并菲啶类生物碱的二聚体。高分辨质谱显示该化合物分子式有41个碳,所以碳谱中缺一个碳信号。
| 表 1 博落回新碱A的1H和13C NMR数据(in CDCl3) |
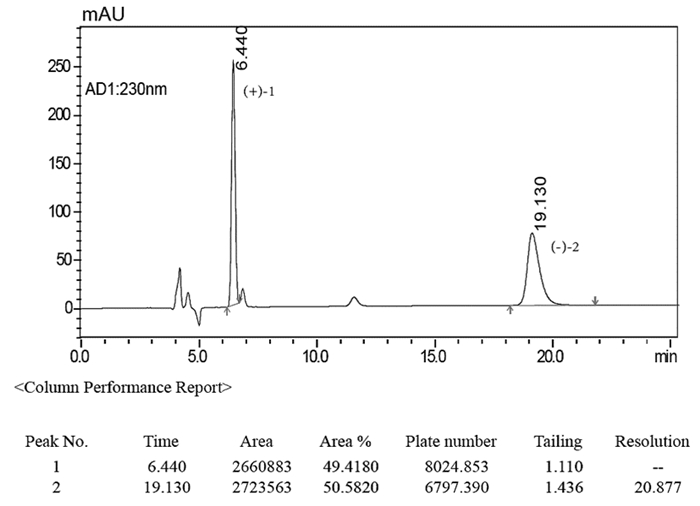
在1H NMR信号中,有2对邻位偶合的芳香氢δH 7.68(H-11), 7.46(H-12) 和7.12(H-10), 6.57(H-9),2个对位的芳香氢δH 7.01(H-1) 和6.61(H-4),2组亚甲二氧基氢δH 6.11(1H, d, J=1.5Hz), 5.95(1H, brs); 5.91(1H, d, J=1.2Hz), 5.89(1H, d, J=1.2Hz),1个N-CH3 δH 2.49(3H, s)。在13C NMR及HSQC谱中也存在与上述氢对应的碳信号。HMBC谱中存在H-1/C-3, C-4a, C-12;H-4/C-2, C-4b, C-12a;H-10/C-6a;H-11/ C-4b, C-10a, C-12a;H-12/ C-1, C-4a, C-10b;5-N-CH3/C-6, C-4b;2组-CH2O-/C-2, C-3, C-7, C-8相关(图 2)。以及在1H-1H COSY谱中存在H-9/H-10和H-11/H-12的相关(图 2)。HRESIMS/MS谱中显示了m/z 332.0969(C20H14NO4)血根碱碎片峰。以上信息均证明该二聚体中存在6-取代二氢血根碱部分[3-4]。剩余1H NMR信号有3个芳香氢信号δH 7.50(1H, br s), 7.07(1H, br d), 6.23(1H, s),1组亚甲二氧基氢信号δH 5.92(1H, d, J=1.4Hz), 5.90(1H, d, J=1.4Hz),2个甲氧基信号δH 3.46(3H, s), 3.95(3H, s),3个亚甲基信号δH 2.56(1H, br s), 1.96(1H, d, J=15.0Hz); 2.39(1H, d, J=10.3Hz), 1.81(1H, br s); 3.07(1H, d, J=13.2Hz), 2.32(1H, br s),碳谱中给出相应的碳信号。以上数据与别隐品碱[5]相似,除了13C NMR谱中缺少羰基信号,1H NMR谱中缺少一个芳香氢信号,表明可能存在别隐品碱部分。所以推测该化合物可能是由二氢血根碱和别隐品碱组成的二聚体,且在C-6和C-13′位通过碳-碳键直接相连,在1H-1H COSY谱中存在H-6/H-13′的相关,证明了该推测。

|
图 2 博落回新碱A的HMBC、1H-1H COSY、NOESY相关图 |
化合物(±)-macleayin A的相对构型是通过关键的NOESY实验确定的(图 2)。在NOESY相关中看不到H-6和H-13′的相关,且这两个氢的偶合常数为9.3Hz,说明这两个氢处于相反的两个面上。然而,由于缺少关键的碳信号(C-14′)、氢信号(H-1′)以及部分关键的HMBC相关信号,不能完全确定该化合物的结构,幸运的是我们成功培养了适合做单晶衍射的晶体。采用Cu靶测试,显示Flack parameter为N,中心对称的空间群(p21/c),结果表明该化合物是外消旋体[6],且旋光数据[α]D25 (c 0.2, CH2Cl2)为0,证明其是外消旋体。解析单晶衍射,结果表明该外消旋体包括(6R, 13′R)和(6S*, 13′S*)二种构型异构体。见图 3。

|
图 3 博落回新碱A的单晶衍射图 (+)-macleayin A(6R,13′R)(-)-macleayin A(6S,13′S) |
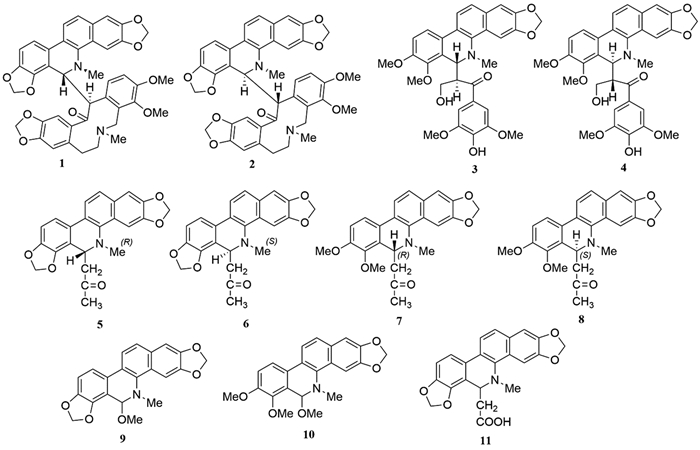
该外消旋体的手性拆分是采用HPLC色谱法,用Daicel Corporation的手性柱CHIRALPAK IB(250mm×4.6mm),流动相为正己烷:乙醇:二乙胺=40:60:0.1,流速为1.0 ml/min,拆分为比例为1:1的1和2,手性拆分的HPLC色谱图见图 4。
|
图 4 ()-博落回新碱A的手性液相色谱图 |
拆分后的二个对映异构体是通过计算ECD确定其绝对构型[7]。输入单晶衍射确定的构象为优势构象,1、2构象都进行含时密度泛函理论电子圆二色谱(TDDFT ECD)计算,得到预测的计算ECD图谱,将计算的ECD图谱和实验测得的ECD图谱进行比对,确定其绝对构型。实验及计算ECD谱图见图 5,1的实测ECD图谱与(6R, 13′R)计算的ECD图谱一致,2的实测ECD图谱与(6S, 13′S)计算的ECD图谱一致,表明1绝对构型为6R, 13′R,2的绝对构型为6S, 13′S。测定其比旋光度为1:[α]D20 (c 0.05, MeOH) +254,2:[α]D20 (c 0.05, MeOH) -230。化合物1和2为未见文献报道的新化合物,故命名1为(+)-博落回新碱A[(+)-macleayin A],2为(-)-博落回新碱A[(-)-macleayin A]。

|
图 5 化合物1和2的实验和计算ECD图谱 |
化合物3和化合物4:化合物(±)-macleayin C为无色簇晶(二氯甲烷:甲醇=1:1)。HRESIMS给出准分子离子峰m/z 596.1892[M+Na]+(calcd.596.1891),确定该化合物分子式为C32H31NO9,其不饱和度为18。紫外光谱中最大吸收峰λmax:227, 281, 320nm。红外光谱(KBr)中给出羰基(1659 cm-1)和苯环(1605, 1492, 1464 cm-1)吸收峰。
13C NMR(100MHz, DMSO-d6)共显示32个碳信号(表 2),高场区有4个甲氧基碳信号(δ 60.5, 55.8, 55.3➨2),1个氮甲基碳信号(δ 41.6);1个羟甲基碳信号δ 61.8(C-9′),2个次甲基碳信号δ 49.5(C-8′)和58.4(C-6);低场区有14个芳香季碳信号(δ 151.7, 146.8, 146.8, 146.7➨ 2, 145.9, 140.3, 138.9, 130.1, 128.8, 126.5, 125.9, 124.2, 123.0),8个芳香次甲基碳信号(δ 123.6, 119.4, 119.2, 112.3, 105.5 ➨2, 103.3, 99.6),共有22个芳香碳信号,初步推测化合物中应有4个苯环,而且有2个苯环骈合在一起;此外低场区还给出1个亚甲二氧基碳信号(δ 100.9) 和1个羰基碳信号δ 201.0(C-7′)。见表 2。
| 表 2 博落回新碱C的NMR数据(DMSO-d6) |
1H NMR(600MHz, DMSO-d6)(表 2)谱图中可以观察到8个芳香氢信号δ 7.85(1H, d, J=8.6Hz), 7.66(1H, d, J=8.6Hz), 7.53(1H, d, J=8.6Hz), 7.14(1H, d, J=8.6Hz), 7.12(1H, s), 6.58(2H, s), 6.44(1H, s)。根据偶合裂分及1H-1H COSY,推测δ 7.85(H-11) 和7.53(H-12),δ 7.66(H-10) 和7.14(H-9) 分别是两个苯环上两组相邻氢信号,δ 7.12(1H, s, H-1) 和δ 6.44(1H, s, H-4) 为同一苯环对位上的两个氢信号;δ 6.58(2H, br s, H-2′, 6′)应为苯环上对称的2个氢;低场区还有1个酚羟基信号δ 8.96(1H, br s, 4′-OH),1组亚甲二氧基氢信号δ 6.07(1H, d, J=1.0Hz), 5.81(1H, d, J=1.0Hz)。在高场区,存在2个次甲基氢信号δ 3.54(1H, ddd, J=11.0, 10.6, 3.6Hz, H-8′)和δ 4.57(1H, d, J=11.0Hz, H-6);1个亚甲基的2个氢信号δ 3.82(1H, ddd, J=10.6, 10.4, 7.4Hz, H-9′a), 3.16(1H, ddd, J=10.4, 3.7, 3.6Hz, H-9′b);4个甲氧基的氢信号δ 3.90(3H, s), 3.84(3H, s), 3.41(6H, s);1个氮甲基的氢信号δ 2.33(3H, s);1个羟基氢信号δ 4.21(1H, dd, J=7.4, 3.7Hz, 9′-OH)。根据以上信息推测该化合物为苯并菲啶类生物碱。
在HMBC谱中,芳香氢信号δ 7.67(H-10) 与芳香季碳δ 123.0(C-10b), 125.9(C-6a)有相关;芳香氢信号δ 7.14(H-9) 与芳香季碳δ 124.2(C-10a)、145.9(C-7)、151.7(C-8) 有相关,且在1H-1H-COSY谱中,δ 7.67, 7.14存在相关;甲氧基氢信号δ 3.90和δ 3.84分别与芳香季碳δ 151.7(C-8)、145.9(C-7) 有相关,故确定结构片段Ⅰ存在。见图 6。
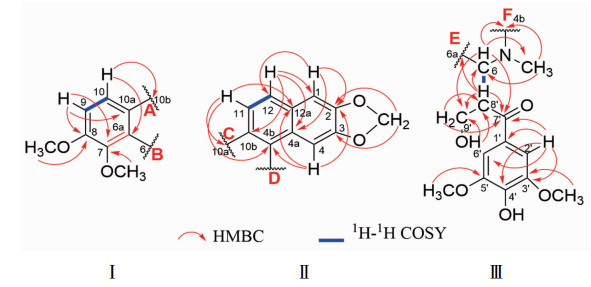
|
图 6 博落回新碱C的HMBC、1H-1H COSY相关图 |
芳香氢信号δ 7.85(H-11) 与芳香季碳δ 124.2(C-10a), 130.1(C-12a), 138.9(C-4b)存在HMBC相关;芳香氢信号δ 7.53(H-12) 与芳香碳δ 103.3(C-1)、123.0(C-10b)、126.5(C-4a)有相关,且在1H-1H COSY谱中,δ 7.85, 7.53存在相关;芳香氢信号δ 7.12(1H, s, H-1) 与芳香碳δ 123.6(C-12)、126.5(C-4a)、146.8(C-3) 有相关;芳香氢信号δ 6.44(1H, s, H-4) 与芳香季碳δ 130.1(C-12a)、138.9(C-4b)、146.8(C-2) 有相关;亚甲二氧基的氢信号δ 6.07(1H, d)、5.81(1H, d)与芳香季碳δ 146.8(C-2, 3) 有相关,故确定结构片段Ⅱ。见图 6。
苯环上呈对称的2个氢δ 6.58(2H, s, H-2′, 6′)与芳香碳δ 128.8(C-1′), 140.3(C-4′), 146.7(C-3′)和羰基碳δ 201.0(C-7′)存在相关,甲氧基氢信号δ 3.41(6H, s)与芳香碳(δ 146.7) 存在相关,表明存在3, 5-二甲氧基-4-羟基苯甲酰基片段。氮甲基氢信号δ 2.33与次甲基碳δ 58.4(C-6) 和芳香季碳δ 138.9(C-4b)存在相关,次甲基氢信号δ 4.57(H-6) 与甲基碳δ 41.6(N-CH3)、次甲基碳δ 49.5(C-8′)、亚甲基碳δ 61.8(C-9′)和芳香季碳δ 124.2(C-10a), 125.9(C-6a), 138.9(C-4b), 145.9(C-7) 存在相关;次甲基氢δ 3.54(H-8′)与碳δ 58.4(C-6), 61.8(C-9′), 125.9(C-6a), 201.0(C-7′)存在相关;亚甲基氢信号δ 3.82(H-9′a), 3.16(H-9′b)与碳信号δ 49.5(C-8′), 201.0(C-7′)存在相关;羟基氢信号δ 4.22(9′-OH)与碳δ 49.5(C-8′), 61.8(C-9′)存在相关;且在1H-1H COSY谱中,δ 4.57(H-6) 和3.54(H-8′)存在相关,δ 3.54(H-8′)和3.82(H-9′a)、3.16(H-9′b)存在相关,δ 3.82(H-9′a)和3.16(H-9′b)存在相关,故确定结构片段Ⅲ。见图 6。
根据H-10与C-10b, H-11与C-10a的HMBC相关,确定结构片段Ⅰ的A端(C-10a)与结构片段Ⅱ的C端(C-10b)相连,即是二氢白屈菜碱部分[8-9];N-CH3信号与C-4b相关,H-6与C-4b, C-6a, C-7, C-10a存在相关,表明结构片段Ⅰ的B端(C-6a)与结构片段Ⅲ的E端(C-6) 相连,结构片段Ⅱ的D端(C-4b)与结构片段Ⅲ的F端(N原子)相连。综上确定了该化合物的平面结构。相对构型的确定是通过H-6和H-8′的偶合常数为J=11.0Hz,且在NOESY谱中观测H-6和N-CH3、H-9′b有相关,H-8′和H-9′a相关(图 7),故H-6和H-8′处于相反的面上。故该化合物是由苯并菲啶类生物碱和苯丙素类通过C-C键相连的杂合体。
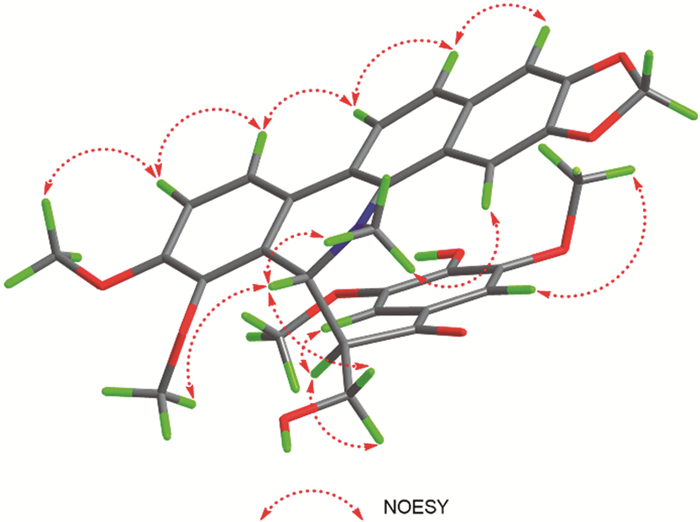
|
图 7 博落回新碱C的NOESY相关图 |
化合物macleayin C的比旋光度为[α]D25 0(c 0.16, CHCl3),推测该化合物可能是外消旋体。用手性HPLC(Chiralpak IC手性柱(250mm×4.6mm))分析,流动相为正己烷:无水乙醇:二乙胺=35:65:0.1,流速1.0ml/min,检测波长280nm,分析结果(图 8)显示有2个峰面积比为1:1的色谱峰,进一步证明macleayin C是外消旋体,并用此条件制备2个对映异构体3和4。

|
图 8 (±)-博落回新碱C的手性液相色谱图 |
3和4的绝对构型是通过计算ECD方法(图 9)确定的,化合物3实测ECD图谱与(6R, 8′R)-macleayin C的计算ECD图谱基本一致,化合物4实测ECD图谱与(6S, 8′S)-macleayin C的计算ECD图谱基本一致,所以确定化合物3的绝对构型是6R, 8′R,4的绝对构型是6S, 8′S。比旋光度分别为3:[α]D20=-85.6(c 0.18, MeOH)和4:[α]D20=+94.4(c 0.18, MeOH)。化合物3和4为未见文献报道的新化合物,命名化合物3为(-)-博落回新碱C[(-)-macleayin C],4为(+)-博落回新碱C[(+)-macleayin C]。
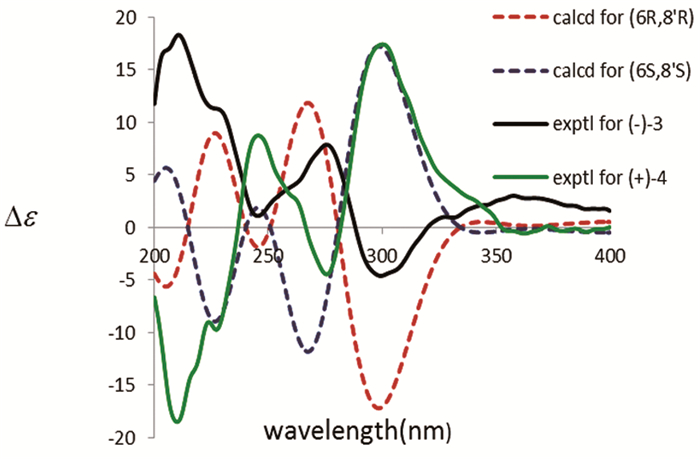
|
图 9 化合物3和4的实验、计算ECD图谱 |
本课题组对另外7个已知化合物也进行了鉴定,分别为(-)-6-丙酮基二氢血根碱(5), (+)-6-丙酮基二氢血根碱(6), (-)-6-丙酮基二氢白屈菜赤碱(7), (+)-6-丙酮基二氢白屈菜赤碱(8), (±)-6-甲氧基二氢血根碱(9), (±)-6-甲氧基二氢白屈菜赤碱(10), (±)-spallidamine(11)。
4 小结从博落回中分离鉴定出7对生物碱外消旋体,其中有4对外消旋体成功采用手性HPLC法进行了拆分,并采用计算ECD、ECD的方法鉴定了其绝对构型,另有三对还没有找到合适的方法对其拆分。外消旋体的发现和拆分,对后续化合物的活性研究及化学合成工作有一定的指导意义,为博落回资源的进一步开发利用奠定了理论基础。
| [1] | 中国科学院中国植物志辑委员会. 中国植物志第32卷[M]. 北京: 科学出版社, 1999: 78. |
| [2] | 南京中医药大学. 中药大辞典[M]. 上海: 上海科学技术出版社, 2006: 3198-3200. |
| [3] | Julián A, Delgado G. (±)-Bocconarborines A and B, novel 1, 3-bis-benzo[c]phenanthridinyl acetone alkaloids from Bocconiaarborea[J]. Revista de la Sociedad Química de México, 2001, 45(4): 189–194. |
| [4] | 叶冯芝, 冯锋, 柳文媛. 博落回的生物碱成分[J]. 中国中药杂志, 2009, 34(13): 1683–1686. |
| [5] | Seger C, Sturm S, Strasser E M, et al. 1H and13C NMR signal assignment of benzylisoquinoline alkaloids fromFumaria officinalis L.(Papaveraceae)[J]. Magnetic Resonance in Chemistry, 2004, 42(10): 882–886. DOI:10.1002/mrc.1417 |
| [6] | Geng CA, Chen XL, Zhou NJ, et al. LC-MS guided isolation of(±)-sweriledugenin A, a pair of enantiomeric lactones, from Swertia leducii[J]. Org Lett, 2014, 16(2): 370–373. DOI:10.1021/ol403198d |
| [7] | Wang KB, Di YT, Bao Y, et al. Peganumine A, a β-carboline dimer with a new octacyclic scaffold from Peganum harmala[J]. Org Lett, 2014, 16(15): 4028–4031. DOI:10.1021/ol501856v |
| [8] | Deng AJ, Qin HL. Cytotoxic dihydrobenzophenanthridine alkaloids from the roots of Macleaya microcarpa[J]. Phytochemistry, 2010, 71(7): 816–822. DOI:10.1016/j.phytochem.2010.02.007 |
| [9] | Miao F, Yang XJ, Zhou L, et al. Structural modification of sanguinarine and chelerythrine and their antibacterial activity[J]. Nat Prod Res, 2011, 25(9): 863–875. DOI:10.1080/14786419.2010.482055 |

