2. 济宁医学院药学院, 日照 276800
2. College of Pharmacy, Jining Medical University, Rizhao 276800, China
熊果酸(ursolic acid,UA),又名乌苏酸,化学名:3β-羟基-乌苏烷型-12-烯-28-羧酸,为五环三萜类化合物。已从白花蛇舌草、熊果、山楂、车前草、夏枯草、栀子、连翘、苹果、梨、西梅等60多种植物中提取到熊果酸[1-3]。结构见图 1。
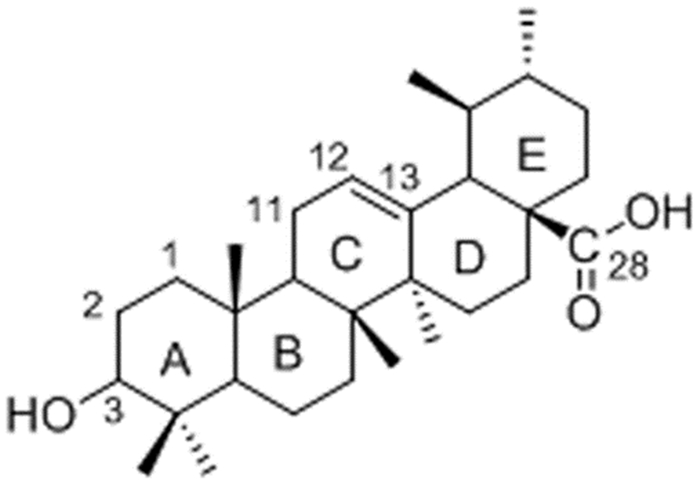
|
图 1 熊果酸的结构图 |
1990年,日本将UA列为最有希望的抗癌药物之一[4]。现代药理学研究表明:UA具有抗炎、抗病毒、抗肿瘤、抗氧化、治疗糖尿病和保肝等多种功效,且毒性小。近年来,对其C-3、C-28和A环进行了系列结构修饰与药理活性研究。本文综述了近年来UA的提取分离、衍生物合成与药理活性等方面的研究进展。
1 熊果酸的提取分离UA属于α-香树脂醇型五环三萜类化合物,具有许多与其它五环三萜类化合物相似的性质,易溶于甲醇、乙醇、乙醚。目前多采用醇类和醚类作为提取溶剂。
通常用回流提取法、渗漉法、超声波提取法、超临界流体萃取法(SFE)等方法从天然植物中提取分离UA。陈鸿英等[5]利用溶剂提取法从泽兰中提取UA,确定提取条件:乙醇体积分数为95%,石油醚脱色,提取次数3次,以氯仿-甲醇(9.5:0.5) 洗脱。牟利辉[6]利用索氏提取法从苦丁茶中提取UA,以乙醚为溶剂,最佳提取时间为3.5h,此法重现性和回收率良好。谷芳芳等[7]以山楂为原料,采用单因素与正交实验相结合的方法,确定最佳工艺条件:乙醇体积分数95%、提取温度85℃、提取时间110 min、液固比5:1、提取次数3次。在该条件下,UA提取率为93.47%。
经粗分得到的UA粗品,需要进一步分离纯化。常用的分离纯化方法为活性炭吸附法、离子交换法和膜分离法。黄超华等[8]以山楂为原料,以90%的乙醇溶液为提取溶剂,在85℃下回流提取,得到的固体提取物用甲醇溶解,再用活性炭脱色、重结晶得到UA晶体。任秀莲等[9]利用超滤技术对苦丁茶提取液进行超滤纯化,确定最佳条件:压力为100~300 kPa,聚醚砜膜分子量为10000 Da,超滤原料液UA浓度为0.55 mg/ml。在这种条件下,UA的透过率为99.2%。
2 熊果酸的生物活性 2.1 抗炎活性Baricevic等[10]以巴豆油诱导的耳部肿胀小鼠为模型,以非甾体抗炎药吲哚美辛为参照,结果表明UA的抗炎活性是吲哚美辛的两倍以上。同时,Rahul Checker等[11]发现UA能够抑制T细胞、B细胞和巨噬细胞的活化、增殖和细胞因子的分泌,还能够抑制分裂素诱导的ERK和JNK的磷酸化,抑制淋巴细胞中免疫调节转录因子NF-кB、NF-AT和AP-1的活化。
UA对正常组织细胞有时会产生一定的促炎作用。UA能够减弱一氧化氮合酶(iNOS)和环氧酶COX-2的表达,抑制人类乳腺上皮细胞产生前列腺素2(PGE2)[12]。因此UA在抗炎方面是一把双刃剑。
2.2 抗肿瘤活性UA具有广谱的抗肿瘤活性,对前列腺癌、肝癌、肺癌、卵巢癌、胃癌和黑色素肿瘤等多种肿瘤细胞株具有抑制作用。UA发挥抗肿瘤作用的机制包括:诱导肿瘤细胞凋亡和分化,抑制侵袭、扩增和血管的生成,促进化疗增敏作用,诱导细胞周期阻滞和自噬等[13]。
UA能够通过各种通路诱导细胞凋亡:激活caspase-3和caspase-9、下调c-IAPs家族蛋白的表达、改变Bax或者p53蛋白的水平、增加Ca2+内流、改变线粒体渗透性等。Meng等[14]研究发现,UA能够通过调控人类前列腺癌细胞(LNCaP and PC-3) 中的PI3K/Akt/mTOR信号通路来诱导细胞凋亡。UA能够诱导内质网应激应答来激活ASK1-JNK信号通路,诱导人膀胱癌细胞T24的凋亡。Yan等[15]报道,通过增加DNA片段化、降低线粒体膜电位、下调Na+-K+-ATP酶的活性、提高caspase-3和caspase-8的活性诱导4种肝癌细胞HepG2、Hep3B、Huh7和HA22T的凋亡,UA还能够抑制血管内皮生长因子(VEGF)和细胞间粘附分子-1(ICAM-1) 的生成。
UA对DNA突变和肿瘤细胞的非正常突变均具有明显的抑制作用。Ohigaschi等[16]研究发现,UA对Raji细胞BVEA的活化具有一定的抑制作用。Huang等[17]研究发现,UA能够明显抑制小鼠皮肤肿瘤的非正常突变,其作用机制主要是它能够增强表皮鸟氨酸脱羧酶(ODC)的活性,减少细胞内多胺的分泌,从而发挥抑制肿瘤细胞的非生长与繁殖作用。
综上所述,UA能够调控与肿瘤细胞生长、增殖、血管生成、凋亡等过程相关分子和蛋白的表达,也能够调节各种与转录因子、蛋白激酶等与肿瘤发生相关分子的表达,发挥其抗肿瘤活性。
2.3 抗病毒活性Kong等[18]首次发现,UA能够显著抑制HCV基因型1b复制子和HCV基因型2aJFH1病毒,其抗HCV病毒的机制部分是由于UA作为非竞争性抑制剂抑制了HCV NS5B RdRp的活性。YIM等[19]通过反向聚合酶链反应(RT-PCR)研究HPV E6/E7基因的表达情况,观察UA的抗病毒活性,结果发现UA能够下调HPV-18 E6/E7的表达。
2.4 肝保护作用UA具有显著的肝保护作用。李开泉等[20]报道,熊果酸在单独使用或与其他药物联合使用时均具有显著的抗肝炎功效,在治疗甲、乙型肝炎的研究中,UA的治愈率高达89.3%,优于对照齐墩果酸(68.0%)。同时,UA具有重要的保肝功效,它能够降低CCl4或APIT所诱导的小鼠肝损伤和肝纤维化标志α-SMA的表达,促进胆汁的分泌,增加胆汁中胆红素的浓度,通过Nrf2/ARE途径实现对肝脏的保护。
UA能够增加骨骼肌和褐色脂肪的量,增强能量消耗,减少体重,提高葡萄糖耐受,减少肝脂肪变性[21]。Li等[22]观察到UA能够显著减轻实验小鼠肝脏的重量、降低ALT/AST的水平和肝脏脂肪变性,并减少L02细胞中棕榈酸诱导的脂肪聚集。进一步研究发现,UA可能是通过增加脂肪的β氧化抑制内质网压力而发挥肝脏保护作用。
2.5 熊果酸的其他生物活性UA在皮肤美容护肤、阿尔茨海默病、糖尿病等领域的应用也比较广泛[3, 23-24]。对CaCl2和肾上腺素诱导的心律失常、缺血/再灌注引起的心率失常和由心肌肥厚和TAC所诱导的心肌纤维化,UA均具有一定的治疗作用[25-26]。体内外实验证明,UA能够通过增加蛋白质合成,减少蛋白质水解,抑制肌生成抑制蛋白和炎症细胞因子的表达,减缓慢性肾病(CKD)引起的肌肉萎缩[27]。UA还具有神经保护、肾脏保护、松弛胃平滑肌、治疗关节炎、治疗自身免疫疾病等多种功效[28]。
3 熊果酸的结构修饰与活性研究UA对许多疾病都具有显著的疗效,由于缺少靶标特异性以及生物利用度低,限制了其在临床应用[28]。为提高UA的靶向选择性及活性,改善其生物利用度及水溶性,许多研究团队对UA进行了结构修饰与活性研究,修饰部位多为C-3、C-28位以及A环的开环与扩环。
3.1 熊果酸C-3位的结构修饰刘丹[29]在保持UA的C-28位不变的情况下,C-3位引入乙酰氧基、丙酰氧基和丁酰氧基,探讨酰氧基碳链的长短、极性和空间位阻等对化合物药理活性的影响。结果表明在10 μmol/L浓度下,化合物1~3(图 2)对HELA细胞的抑制率分别为37.84%、21.54%和40.48%,且发现其衍生物3对SK-OV3肿瘤细胞的抑制活性优于2。

|
图 2 化合物1~3结构图 |
Tang等[30]将UA的C-3位羟基与阿司匹林(Asp)直接通过共价键连接,得到新缀合物4(图 3),并测试了其抗肿瘤活性。结果表明,4能够下调肿瘤细胞粘附分子和侵袭分子的表达,能更有效地抑制小鼠乳腺癌4T1细胞在乳腺癌转移小鼠模型体内的肺转移,其机制与小鼠体内CD44表达减弱有关。
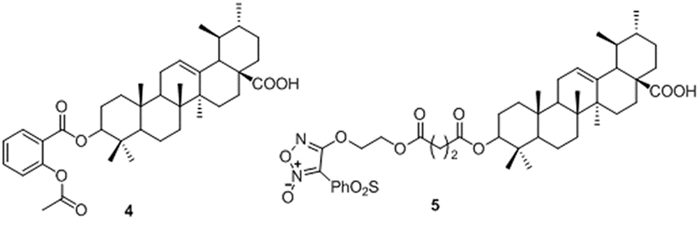
|
图 3 化合物4和5结构图 |
Chen等[31]将苯磺酰基取代呋咱与UA的C-3位羟基偶联,得到了一系列一氧化氮供体型UA衍生物,并通过MTT法检测其对人肝癌HepG2细胞的抑制活性,结果表明化合物5(图 3)的IC50为3.2 μmol/L,表现较强的抑制活性。
3.2 熊果酸C-28的结构修饰Showkat Rashid等[32]将UA的3位羟基氧化,并在28位引入不同取代的苄基,其中化合物6~9(图 4)在体外细胞活性筛选过程中,表现出良好的细胞毒活性,对部分肿瘤细胞A-549,MCF-7,HCT-116,THP-1和FR-2的IC50值均小于0.1 μM。
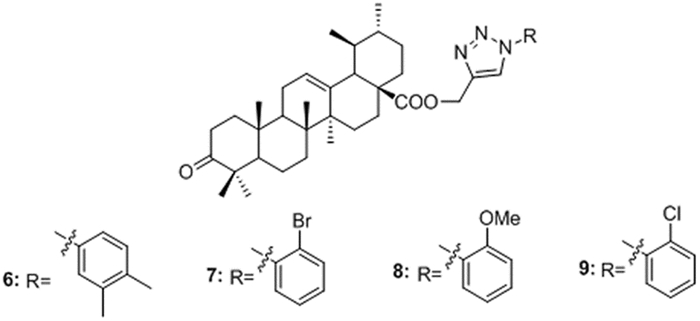
|
图 4 化合物6~9结构图 |
Huang等[33]对UA的3-OH和28-COOH位进行修饰,在C-3位或C-28位引入长链的亲水基团,并保持分子结构中只有一个羧基,得到化合物10~13(图 5),对α-糖苷酶的抑制活性是UA的12~30倍。
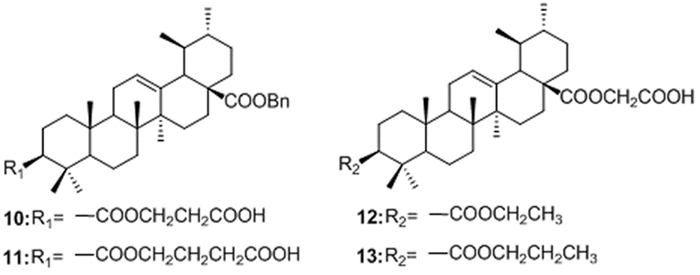
|
图 5 化合物10~13结构图 |
孟艳秋课题组将UA的3位羟基乙酰化,再对28-COOH进行结构修饰,得到了一系列UA衍生物,通过MTT法对其进行检测,其中化合物14和15(图 6)对Hela细胞的抑制活性最强,IC50分别为1.63 μmol/L和2.71 μmol/L[34-35]。

|
图 6 化合物14和15结构图 |
UA的哌嗪衍生物能够显著提高其抗肿瘤活性。Shao等[36-37]将3-乙酰基UA的C-28位引入哌嗪,得到化合物16和17(图 7)对HepG2细胞和Hela细胞具有显著抑制活性。分子对接研究表明,化合物16和17均能够与葡萄糖激酶、葡萄糖转运蛋白(GLUT1) 和ATP激酶结合,表明其具有开发为靶向调节肿瘤细胞糖代谢药物的前景。Yang等[38]在UA的C-28位接入乙基哌嗪,再在哌嗪上连接各种芳香取代基团,多数衍生物体外抗肿瘤活性较UA显著增强,并对化合物18(图 8)的抗肿瘤活性机制进行了深入研究。
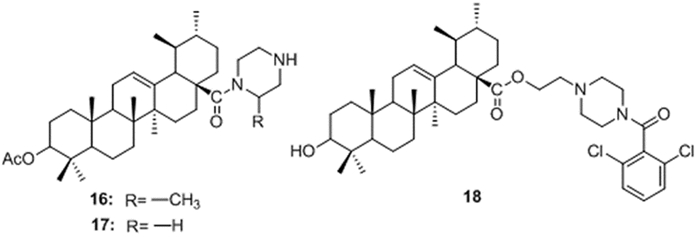
|
图 7 化合物16~18结构图 |
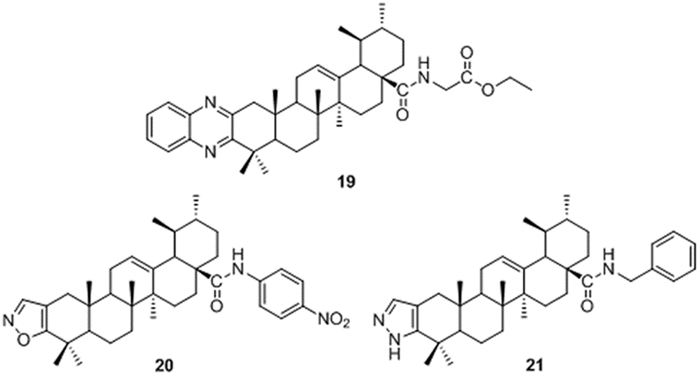
|
图 8 化合物19~21结构图 |
Fu等[39-40]在UA的C2-C3位骈合含氮杂环,并对其28位进行结构修饰,得到了一系列衍生物,其中19和20(图 8)能与色氨酸羟化酶1(Tph-1) 结合(KD值分别为6.82 μM和15.09 μM),抑制Tph-1的相关蛋白和mRNA的表达,降低血液和内脏中5-HT的含量,而大脑中的5-HT不受影响。研究结果表明,化合物19和20能够通过抑制5-HT的合成阻止的骨丢失,且不产生雌激素样副作用。
孟艳秋等[41]在UA的C2-C3位骈合吡唑环,并在C-28位引入苄氨,得到衍生物21(图 8),MTT法测得21对SGC7901肿瘤细胞的IC50为0.04 μmol/L,优于阳性对照药吉非替尼(IC50=1.03 μmol/L)。
Mendes等[13]对UA的A环进行结构修饰,得到了A环为内酯、内酰胺和A环开环的UA衍生物,其中A环开环的衍生物22(图 9)活性最强,对H460和H322细胞具有较强的抑制活性,IC50分别为2.6 μmol/L和3.3 μmol/L。

|
图 9 化合物22结构图 |
熊果酸广泛存在于自然植物中,储量丰富,提取工艺简便。以熊果酸为主要有效成分的中成药在临床中被广泛使用,其安全性得到了确证。现代药理学研究表明,熊果酸能够通过诱导肿瘤细胞凋亡、分化、抑制侵袭、扩增和血管的生成、促进化疗增敏作用、诱导细胞周期阻滞和自噬等途径发挥抗肿瘤作用。
熊果酸水溶性差、生物利用度低、缺乏靶标特异性,限制了其作为抗肿瘤药物的临床应用。目前对熊果酸的有效结构与必需的活性官能团、有利取代位和取代基的研究已取得了一些进展,但要获得理想的候选药物,还需要进一步的研究探索。因此,寻找高效、低毒的熊果酸衍生物,并探究其在生物体内的作用机制,是一项有价值和前景的研究工作。
| [1] | Cargnin ST, Gnoatto SB. Ursolic acid from apple pomace and traditional plants:A valuable triterpenoid with functional properties[J]. Food Chem, 2017, 220: 477–489. DOI:10.1016/j.foodchem.2016.10.029 |
| [2] | 陶渊博, 邢雅丽, 方芝娟, 等. 生物活性物质熊果酸资源分布状况研究进展[J]. 林产化学与工业, 2012, 32(1): 119–126. |
| [3] | 孟艳秋, 陈瑜, 王趱, 等. 熊果酸的研究进展[J]. 中国新药杂志, 2007, 16(1): 25–28. DOI:10.3321/j.issn:1003-3734.2007.01.007 |
| [4] | Muto Y, Ninomiya M, Fujiki H. Present status of research on cancer chemoprevention in Japan[J]. Jpn J Clin Oncol, 1990, 20(3): 219–224. |
| [5] | 陈鸿英, 马雪梅. 泽兰中齐墩果酸和熊果酸的提取、分离[J]. 天津中医药, 2003, 20(5): 74–75. DOI:10.3969/j.issn.1672-1519.2003.05.030 |
| [6] | 牟利辉. 苦丁茶中熊果酸的提取及含量测定研究[J]. 广东化工, 2005, 32(3): 49–50, 68. DOI:10.3969/j.issn.1007-1865.2005.03.020 |
| [7] | 谷芳芳, 任凤莲. 山楂叶中熊果酸提取工艺研究[J]. 广州化学, 2006, 31(1): 35–39, 45. DOI:10.3969/j.issn.1009-220X.2006.01.008 |
| [8] | 黄超华, 吴杰, 骆妃静. 山楂中熊果酸的提取与分离[J]. 西北药学杂志, 2009, 24(6): 459–460. DOI:10.3969/j.issn.1004-2407.2009.06.016 |
| [9] | 任秀莲. 苦丁茶中熊果酸的分离纯化研究[D]. 长沙: 中南大学, 2004. 10.7666/d.y627063. http://cdmd.cnki.com.cn/Article/CDMD-10533-2004116238.htm |
| [10] | Baricevic D, Sosa S, Della Loggia R, et al. Topical anti-inflammatory activity of Salvia officinalis L.leaves:the relevance of ursolic acid[J]. J Ethnopharmacol, 2001, 75(2-3): 125–132. DOI:10.1016/s0378-8741(00)00396-2 |
| [11] | Checker R, Sandur SK, Sharma D, et al. Potent anti-inflammatory activity of ursolic acid, a triterpenoid antioxidant, is mediated through suppression of NF-κB, AP-1 and NF-AT[J]. PLoS One, 2012, 7(2): e31318. DOI:10.1371/journal.pone.0031318 |
| [12] | Ikeda Y, Murakami A, Ohigashi H. Ursolic acid:an anti-and pro-inflammatory triterpenoid[J]. Mol Nutr Food Res, 2008, 52(1): 26–42. DOI:10.1002/mnfr.200700389 |
| [13] | Mendes VI, Bartholomeusz GA, Ayres M, et al. Synthesis and cytotoxic activity of novel A-ring cleaved ursolic acid derivatives in human non-small cell lung cancer cells[J]. Eur J Med Chem, 2016, 123: 317–331. DOI:10.1016/j.ejmech.2016.07.045 |
| [14] | Meng Y, Lin ZM, Ge N, et al. Ursolic acid induces apoptosis of prostate cancer cells via the PI3K/Akt/mTOR pathway[J]. Am J Chin Med, 2015, 43(7): 1471–1486. DOI:10.1142/S0192415X15500834 |
| [15] | Yan SL, Huang CY, Wu ST, et al. Oleanolic acid and ursolic acid induce apoptosis in four human liver cancer cell lines[J]. Toxicol In Vitro, 2010, 24(3): 842–848. DOI:10.1016/j.tiv.2009.12.008 |
| [16] | Ohigashi H, Takamura H, Koshimizu K, et al. Search for possible antitumor promoters by inhibition of 12-O-tetra-decanoylphorbol-13-acetate-induced Epstein-Barr virus activation; ursolic acid and oleanolic acid from an anti-inflammatory Chinese medicinal plant, Glechoma hederaceae L[J]. Cancer Lett, 1986, 30(2): 143–151. DOI:10.1016/0304-3835(86)90082-0 |
| [17] | Huang C, Ma WY, Goranson A, et al. Resveratrol suppresses cell transformation and induces apoptosis through a p53-dependent pathway[J]. Carcinogenesis, 1999, 20(2): 237–242. DOI:10.1093/carcin/20.2.237 |
| [18] | Kong L, Li S, Liao Q, et al. Oleanolic acid and ursolic acid:novel hepatitis C virus antivirals that inhibit NS5B activity[J]. Antiviral Res, 2013, 98(1): 44–53. DOI:10.1016/j.antiviral.2013.02.003 |
| [19] | Yim EK, Lee MJ, Lee KH, et al. Antiproliferative and antiviral mechanisms of ursolic acid and dexamethasone in cervical carcinoma cell lines[J]. Int J Gynecol Cancer, 2006, 16(6): 2023–2031. DOI:10.1111/j.1525-1438.2006.00726.x |
| [20] | 李开泉, 陈武, 熊筱娟, 等. 乌索酸的化学、药理及临床应用进展[J]. 中成药, 2002, 24(9): 709–711. DOI:10.3969/j.issn.1001-1528.2002.09.023 |
| [21] | Kunkel S D, Elmore C J, Bongers K S, et al. Ursolic acid increases skeletal muscle and brown fat and decreases diet-induced obesity, glucose intolerance and fatty liver disease[J]. PLoS One, 2012, 7(6): e39332. DOI:10.1371/journal.pone.0039332 |
| [22] | Li JS, Wang WJ, Sun Y, et al. Ursolic acid inhibits the development of nonalcoholic fatty liver disease by attenuating endoplasmic reticulum stress[J]. Food Funct, 2015, 6(5): 1643–1651. DOI:10.1039/c5fo00083a |
| [23] | Wilkinson K, Boyd JD, Glicksman M, et al. A high content drug screen identifies ursolic acid as an inhibitor of amyloid beta protein interactions with its receptor CD36[J]. J Biol Chem, 2011, 286(40): 34914–34922. DOI:10.1074/jbc.M111.232116 |
| [24] | Zhang W, Hong D, Zhou Y, et al. Ursolic acid and its derivative inhibit protein tyrosine phosphatase 1B, enhancing insulin receptor phosphorylation and stimulating glucose uptake[J]. Biochim Biophys Acta, 2006, 1760(10): 1505–1512. DOI:10.1016/j.bbagen.2006.05.009 |
| [25] | Somova LI, Shode FO, Mipando M. Cardiotonic and antidysrhythmic effects of oleanolic and ursolic acids, methyl maslinate and uvaol[J]. Phytomedicine, 2004, 11(2-3): 121–129. DOI:10.1078/0944-7113-00329 |
| [26] | Dong X, Liu S, Zhang L, et al. Downregulation of miR-21 is involved in direct actions of ursolic acid on the heart:implications for cardiac fibrosis and hypertrophy[J]. Cardiovasc Ther, 2015, 33(4): 161–167. DOI:10.1111/1755-5922.12125 |
| [27] | Yu R, Chen JA, Xu J, et al. Suppression of muscle wasting by the plant-derived compound ursolic acid in a model of chronic kidney disease[J]. J Cachexia Sarcopenia Muscle, 2017, 8(2): 327–341. DOI:10.1002/jcsm.12162 |
| [28] | Kashyap D, Tuli HS, Sharma AK. Ursolic acid(UA):A metabolite with promising therapeutic potential[J]. Life Sci, 2016, 146: 201–213. DOI:10.1016/j.lfs.2016.01.017 |
| [29] | 刘丹. 熊果酸衍生物的设计、合成及其抗肿瘤活性的研究[D]. 天津: 天津大学, 2007. http://kns.cnki.net/KCMS/detail/detail.aspx?filename=sdyg201609005&dbname=CJFD&dbcode=CJFQ |
| [30] | Tang Q, Liu Y, Li T, et al. A novel co-drug of aspirin and ursolic acid interrupts adhesion, invasion and migration of cancer cells to vascular endothelium via regulating EMT and EGFR-mediated signaling pathways:multiple targets for cancer metastasis prevention and treatment[J]. Oncotarget, 2016, 7(45): 73114–73129. DOI:10.18632/oncotarget.12232 |
| [31] | Chen L, Qiu W, Tang J, et al. Synthesis and bioactivity of novel nitric oxide-releasing ursolic acid derivatives[J]. Chinese Chem Lett, 2011, 22(4): 413–416. DOI:10.1016/j.cclet.2010.10.036 |
| [32] | Rashid S, Dar BA, Majeed R, et al. Synthesis and biological evaluation of ursolic acid-triazolyl derivatives as potential anti-cancer agents[J]. Eur J Med Chem, 2013, 66: 238–245. DOI:10.1016/j.ejmech.2013.05.029 |
| [33] | Huang T, Wu P, Cheng A, et al. A hydrophilic conjugate approach toward the design and synthesis of ursolic acid derivatives as potential antidiabetic agent[J]. RSC Adv, 2015, 5(55): 44234–44246. DOI:10.1039/c5ra05450h |
| [34] | Liu D. Synthesis and anti-tumor activity of novel amide derivatives of Ursolic acid[J]. Chemical Research in Chinese Universities, 2008, 24(1): 42–46. DOI:10.1016/s1005-9040(08)60010-0 |
| [35] | Meng Y, Song Y, Yan Z, et al. Synthesis and in vitro cytotoxicity of novel ursolic acid derivatives[J]. Molecules, 2010, 15(6): 4033–4040. DOI:10.3390/molecules15064033 |
| [36] | Dong H, Yang X, Xie J, et al. UP12, a novel ursolic acid derivative with potential for targeting multiple signaling pathways in hepatocellular carcinoma[J]. Biochem Pharmacol, 2015, 93(2): 151–162. DOI:10.1016/j.bcp.2014.11.014 |
| [37] | Yang X, Li Y, Jiang W, et al. Synthesis and biological evaluation of novel Ursolic acid derivatives aspotential anticancer prodrugs[J]. Chem Biol Drug Des, 2015, 86(6): 1397–1404. DOI:10.1111/cbdd.12608 |
| [38] | Liu MC, Yang SJ, Jin LH, et al. Synthesis and cytotoxicity of novel ursolic acid derivatives containing an acyl piperazine moiety[J]. Eur J Med Chem, 2012, 58: 128–135. DOI:10.1016/j.ejmech.2012.08.048 |
| [39] | Fu HJ, Zhou YR, Bao BH, et al. Tryptophan hydroxylase 1(Tph-1)-targeted bone anabolic agents for osteoporosis[J]. J Med Chem, 2014, 57(11): 4692–4709. DOI:10.1021/jm5002293 |
| [40] | Fu HJ, Zhao Y, Zhou YR, et al. Ursolic acid derivatives as bone anabolic agents targeted to tryptophan hydroxylase 1(Tph-1)[J]. Eur J Pharm Sci, 2015, 76: 33–47. DOI:10.1016/j.ejps.2015.04.021 |
| [41] | Meng Y, Cao J, Tang Y, et al. Synthesis and anti-tumor activity of derivatives of ring A of Ursolic acid[J]. Chinese Journal of Organic Chemistry, 2016, 36(5): 1080. DOI:10.6023/cjoc201510034 |


 孟庆国, 教授, 理学博士, 博士生导师, 药物化学与制药工程方向带头人。2001年毕业于中国协和医科大学微生物与生化药学专业, 获理学博士学位。2001年11月至2004年3月, 军事医学科学院毒物药物研究所, 药物化学专业博士后流动站。2004年至今烟台大学药学院。主要从事具有抗心肌缺血、抗菌、抗肿瘤、抗炎、抗病毒等活性天然药物修饰以及全合成。Chemical Biology & Drug Design、Chinese Chemical Letter、Bioorganic Medicinal Letter及中国新药杂志审稿人, 国家自然科学基金通讯评审专家、山东省自然科学基金结题/评审专家、山东省重点科技发展计划、重大新药创制评审专家、中国药学会老年药学专业委员会委员、山东省药物化学专业委员会委员。先后承担国家自然科学基金、国家科技重大专项和山东省自然科学基金等课题。近五年组织完成新药研究1项(获临床批件); 申报发明专利9项, 获得授权5项。获2014年山东高等学校优秀科研成果三等奖(1/2)。指导11届硕士毕业生, 分别获山东省优秀硕士学位论文(指导教师)和山东省优秀学士学位论文(指导教师。迄今已发表论文90余篇, 其中以通信作者或第一作者发表SCI论文30余篇
孟庆国, 教授, 理学博士, 博士生导师, 药物化学与制药工程方向带头人。2001年毕业于中国协和医科大学微生物与生化药学专业, 获理学博士学位。2001年11月至2004年3月, 军事医学科学院毒物药物研究所, 药物化学专业博士后流动站。2004年至今烟台大学药学院。主要从事具有抗心肌缺血、抗菌、抗肿瘤、抗炎、抗病毒等活性天然药物修饰以及全合成。Chemical Biology & Drug Design、Chinese Chemical Letter、Bioorganic Medicinal Letter及中国新药杂志审稿人, 国家自然科学基金通讯评审专家、山东省自然科学基金结题/评审专家、山东省重点科技发展计划、重大新药创制评审专家、中国药学会老年药学专业委员会委员、山东省药物化学专业委员会委员。先后承担国家自然科学基金、国家科技重大专项和山东省自然科学基金等课题。近五年组织完成新药研究1项(获临床批件); 申报发明专利9项, 获得授权5项。获2014年山东高等学校优秀科研成果三等奖(1/2)。指导11届硕士毕业生, 分别获山东省优秀硕士学位论文(指导教师)和山东省优秀学士学位论文(指导教师。迄今已发表论文90余篇, 其中以通信作者或第一作者发表SCI论文30余篇