在肝切除、肝移植、严重的肝外伤处理以及严重的休克等过程中都会造成肝缺血-再灌注损伤,直接影响手术的成功率和患者的存活率。其损伤机制与大量氧自由基的产生有关[1]。芒果苷又名芒果素,是一种多酚类化合物,具有止咳平喘、抗炎镇痛、保肝利胆的功效,近年来随着研究的深入,发现芒果苷还具有抗氧化、抗癌、抗病毒等作用[2-3]。本实验采用小鼠肝缺血-再灌注损伤模型观察芒果苷对小鼠肝缺血-再灌注损伤的保护作用,并探讨其作用机制,为芒果苷的临床应用提供理论依据。
1 材料与方法 1.1 实验动物健康成年雄性昆明小鼠24只(由济宁医学院实验动物中心提供),随机分成3组:假手术组(sham组)、缺血-再灌注损伤组(I/R组)、芒果苷组,每组8只。
1.2 试剂芒果苷购于广西百色市天星植物科技有限公司;丙氨酸氨基转移酶(ALT)、超氧化物歧化酶(SOD)、丙二醛(MDA)、谷胱甘肽过氧化物酶(GSH-Px)试剂盒购于南京建成试剂公司;兔抗Caspase-3、Bcl-2、Bax多克隆抗体购自Signalway Antibody公司;全蛋白抽提试剂盒、BCA蛋白测定试剂盒购自南京凯基生物有限公司;化学发光液和硝酸纤维素购自密理博中国有限公司。
1.3 方法 1.3.1 模型制备及药物预处理小鼠称重,以10%水合氯醛4ml/kg腹腔注射麻醉,上腹部做正中切口,充分暴露第一肝门,游离肝门血管,用小号无创血管夹夹闭第一肝门。30min后去除血管夹,恢复血流,再灌注6h制作肝缺血-再灌注损伤模型。芒果苷组在缺血前30min腹腔注射20mg/kg芒果苷,sham组和I/R组腹腔注射等容量生理盐水。sham组仅麻醉、开腹,分离肝血管,不阻断血供。实验过程中动物体温维持在37℃。
1.3.2 肝细胞形态观察再灌注结束后处死小鼠,取肝组织, 置于10%中性福尔马林溶液固定24h以上,30%蔗糖沉底过夜,冰冻切片(厚9μm),苏木素-伊红(HE)染色,光镜下观察细胞形态的变化。
1.3.3 ALT、MDA、SOD和GSH-Px的含量检测再灌注6h时,心脏采血,室温静置90min,4000r/min离心5min后取血清,按试剂盒说明书操作,测血清中ALT水平;取肝组织用冰冷的生理盐水漂洗3次,滤纸拭干,称重后按重量(g):体积(ml)=1:9的比例加入生理盐水,用匀浆器研磨后,3000r/min离心10min,取上清,即为10%组织匀浆,按试剂盒说明书操作,测肝组织匀浆中MDA、SOD和GSH-Px的含量。
1.3.4 肝组织中Caspase-3、Bcl-2、Bax蛋白的检测每组选取4只动物作为检测蛋白表达标本,按试剂盒说明提取总蛋白,BCA试剂盒蛋白定量后,取120μg蛋白用10% SDS-PAGE进行电泳。90V恒压将蛋白转至醋酸纤维膜(NC膜),转膜时间70min。室温下将NC膜用5%脱脂奶粉封闭2h,加兔抗鼠Caspase-3、Bcl-2、Bax一抗(1:1000) 稀释液,4℃孵育过夜。洗液漂洗3次,每次10min。加辣根过氧化物酶标记的羊抗兔二抗(1:1000),室温孵育2h。洗液漂洗3次,每次10min。加ECL试剂显色后用全自动化学发光成像系统(Bio-Rad XRP+)成像检测。
1.4 统计学方法采用SPSS18.0统计软件对结果进行分析,所有数据均以(x±s)表示,多组间比较采用单因素方差分析,两两比较采用LSD-t检验,P<0.05则差异具有统计学意义。
2 结果 2.1 芒果苷对缺血-再灌注后肝细胞形态和功能的影响sham组肝组织肝索排列清晰,肝细胞结构完整,未见变性坏死、炎细胞浸润等病理学变化。I/R组可见局灶性坏死,肝细胞排列紊乱,部分肝索、肝血窦分界不清,肝细胞呈空泡变性,门管区有大量炎细胞浸润。芒果苷组肝细胞水肿减轻,中央静脉、肝索结构清晰,病理损害明显较I/R组减轻。见图 1。
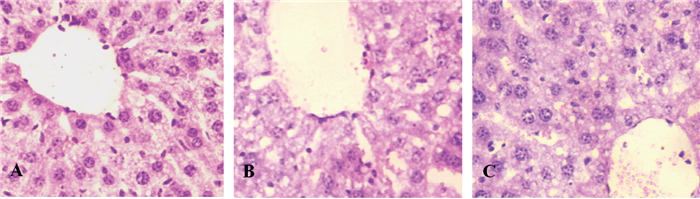
|
图 1 芒果苷可减轻肝缺血-再灌注损伤引起的肝细胞形态学改变(HE×400) 注:A.sham组;B.I/R组;C.芒果苷组 |
血清ALT水平可反映肝细胞损害和坏死的程度。结果显示,与sham组相比,I/R组血清ALT水平明显升高,差异具有统计学意义(t=11.41,P<0.05)。与I/R组相比,芒果苷组血清ALT水平明显降低,差异具有统计学意义(t=-7.22,P<0.05),说明芒果苷预处理可减少缺血-再灌注后ALT的释放。见表 1。
| 表 1 芒果苷对缺血-再灌注后血清中ALT和肝组织中MDA、SOD、GSH-Px含量的影响(x±s) |
数据显示,与sham组相比,I/R组MDA含量上升,差异有统计学意义(t=8.09,P<0.05),表明肝组织遭受严重的氧化损伤;芒果苷组MDA含量明显降低,与I/R组相比差异有统计学意义(t=-3.07,P<0.05)。与sham组相比,I/R组SOD含量明显下降,差异有统计学意义(t=-5.83,P<0.05);芒果苷组SOD含量明显升高,与I/R组相比差异有统计学意义(t=3.34,P<0.05)。与此同时,I/R组GSH-Px含量明显下降,与sham组相比差异有统计学意义(t=-7.96,P<0.05);芒果苷组GSH-Px含量明显升高,与I/R组相比差异有统计学意义(t=3.32,P<0.05)。提示芒果苷可以减少缺血-再灌注后肝组织中脂质过氧化物的产生,并提高抗氧化酶的活性。见表 1。
2.3 芒果苷对缺血-再灌注后肝组织中Caspase-3,Bcl-2及Bax蛋白表达的影响数据显示,与sham组相比,I/R组Caspase-3蛋白表达上升,差异有统计学意义(t=7.75,P<0.05),与I/R组相比,芒果苷组Caspase-3蛋白表达下降,差异有统计学意义(t=-3.18,P<0.05);与sham组相比,I/R组Bcl-2蛋白表达下降,差异有统计学意义(t=-8.41,P<0.05),与I/R组相比,芒果苷组Bcl-2蛋白表达升高,差异有统计学意义(t=4.47,P<0.05);与sham组相比,I/R组Bax蛋白表达升高,差异有统计学意义(t=11.69,P<0.05),与I/R组相比,芒果苷组Bax蛋白表达下降,差异有统计学意义(t=-8.86,P<0.05)。提示芒果苷可以降低缺血-再灌注后肝组织中凋亡蛋白的表达,减少肝细胞凋亡。见表 2、图 2。
| 表 2 芒果苷对缺血-再灌注后肝组织中Caspase-3,Bcl-2及Bax蛋白表达的影响(x±s) |
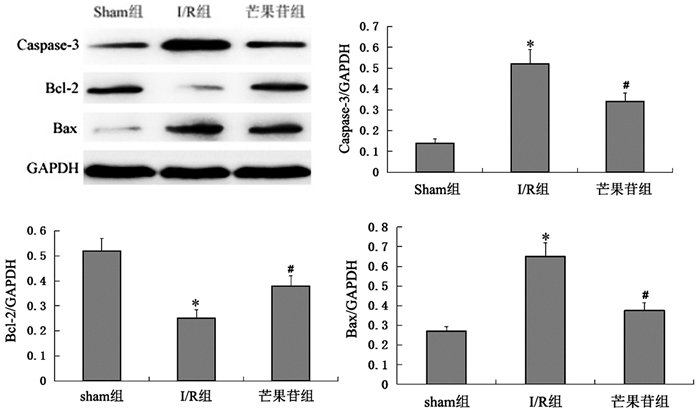
|
图 2 芒果苷对缺血-再灌注后肝组织中Caspase-3,Bcl-2及Bax蛋白表达的影响 与sham组相比*P<0.01;与I/R组相比#P<0.01 |
缺血-再灌注损伤(I/R)是指缺血组织恢复血液供应后反而出现损伤加重的现象[4]。其发生机制十分复杂,其中氧自由基生成增加是引起缺血-再灌注损伤的重要原因。芒果苷及其衍生物具有很强的抗氧化作用,对脑、心脏和肾脏等氧化损伤有很好的保护作用[5-9],因此, 我们推测其对肝缺血-再灌注损伤具有保护作用。本实验通过复制小鼠肝缺血-再灌注损伤模型发现,缺血-再灌注后肝组织变性、坏死,肝索断裂、排列紊乱,血清中ALT水平上升,表明肝功能受损严重,造模成功。与缺血-再灌注组比较,芒果苷组ALT水平明显降低,说明芒果苷能改善肝功能,对肝缺血-再灌注损伤有显著的保护作用,但其机制尚不明确。进一步研究发现,缺血-再灌注后肝组织中MDA含量升高,SOD和GSH-Px含量下降。说明再灌注后氧自由基产生过多,抗氧化酶耗尽,引起脂质过氧化损伤,使肝组织结构和功能受到破坏。与以往的研究结果一致[10]。经芒果苷处理后,肝组织中MDA含量下降,SOD和GSH-Px含量升高,肝组织损伤减轻。说明芒果苷能够抑制缺血-再灌注后脂质过氧化,增加活性氧的清除,从而保护肝细胞。
细胞凋亡是引起缺血-再灌注损伤的另一重要原因[6]。Bcl-2和Bax是一对调节细胞凋亡的基因,Bcl-2表达上升,能抑制细胞凋亡;Bax表达上升,能促进细胞凋亡。Caspase-3是最关键的凋亡蛋白酶,活化后可激活细胞凋亡通路引起细胞凋亡。本文结果显示,缺血-再灌注后肝组织中Caspas-3和Bax蛋白表达上升,Bcl-2蛋白表达下降,细胞凋亡通路激活;芒果苷能降低肝组织中Caspase-3及Bax蛋白的表达,上调Bcl-2蛋白表达,说明芒果苷可以通过抑制细胞凋亡来发挥对肝脏的保护作用。
综上所述,本研究表明芒果苷通过提高机体抗氧化系统的活性、减轻脂质过氧化损伤和抑制细胞凋亡对小鼠肝缺血-再灌注损伤产生保护作用,为芒果苷的临床应用提供了一定的理论依据,并为进一步开发利用我国中药材提供了重要线索。
| [1] | Wu JX, Zhang LY, Chen YL, et al. Curcumin pretreatment and post-treatment both improve the antioxidative ability of neurons with oxygen-glucose deprivation[J]. Neural Regen Res, 2015, 10(3): 481–489. DOI:10.4103/1673-5374.153700 |
| [2] | Rammohan A, Gunasekar D, Reddy NV, et al. Structure elucidation and antioxidant activity of the phenolic compounds from Rhynchosia suaveolens[J]. Nat Prod Commun, 2015, 10(4): 609–611. |
| [3] | Abdel-Mageed WM, Bayoumi SA, Chen C, et al. Benzophenone C-glucosides and gallotannins from mango tree stem bark with broad-spectrum anti-viral activity[J]. Bioorg Med Chem, 2014, 22(7): 2236–2243. DOI:10.1016/j.bmc.2014.02.014 |
| [4] | Yang Z, Weian C, Susu H, et al. Protective effects of mangiferin on cerebral ischemia-reperfusion injury and its mechanisms[J]. Eur J Pharmacol, 2016, 771: 145–151. DOI:10.1016/j.ejphar.2015.12.003 |
| [5] | Luo Y, Fu C, Wang Z, et al. Mangiferin attenuates contusive spinal cord injury in rats through the regulation of oxidative stress, inflammation and the Bcl-2 and Bax pathway[J]. Mol Med Rep, 2015, 12(5): 7132–7138. DOI:10.3892/mmr.2015.4274 |
| [6] | Sahoo BK, Zaidi AH, Gupta P, et al. A natural xanthone increases catalase activity but decreases NF-kappa B and lipid peroxidation in U-937 and HepG2 cell lines[J]. Eur J Pharmacol, 2015, 764: 520–528. DOI:10.1016/j.ejphar.2015.07.046 |
| [7] | He L, Peng X, Zhu J, et al. Mangiferin attenuate sepsis-induced acute kidney injury via antioxidant and anti-inflammatory effects[J]. Am J Nephrol, 2014, 40(5): 441–450. DOI:10.1159/000369220 |
| [8] | Wang B, Wan J, Gong X, et al. Mangiferin attenuates renal ischemia-reperfusion injury by inhibiting inflammation and inducing adenosine production[J]. Int Immunopharmacol, 2015, 25(1): 148–154. DOI:10.1016/j.intimp.2014.11.011 |
| [9] | Arozal W, Suyatna FD, Juniantito V, et al. The Effects of Mangiferin (Mangifera indica L) in Doxorubicin-induced Cardiotoxicity in Rats[J]. Drug Res (Stuttg), 2015, 65(11): 574–580. DOI:10.1055/s-0034-1394457 |
| [10] | 史才兴, 杜晓东, 姜政辰, 等. N-acetylserotonin对肝缺血-再灌注小鼠氧化应激损伤的保护作用[J]. 中国组织化学与细胞化学杂志, 2013, 22(1): 13–16. DOI:10.3870/zgzzhx.2013.01.003 |



