2. 济宁医学院附属医院, 济宁 272029
2. The Affiliated Hospital of Jining Medical University, Jining 272029, China
胶质瘤是颅内最常见的恶性肿瘤。目前胶质瘤的治疗首选手术切除联合术后同步放疗和替莫唑胺(Temozolomide,TMZ)化疗的综合治疗[1],但患者即使接受综合治疗,其预后仍较差[2]。胶质瘤干细胞介导的化疗耐药途径在TMZ耐药机制中发挥重要作用,虽然胶质瘤干细胞数量少,但广泛存在于胶质瘤组织和胶质瘤细胞系中,被认为是胶质瘤发生、发展的种子细胞,是胶质瘤发生、发展与维持的基础,与胶质瘤的复发、转移和对药物治疗抵抗有关[3]。目前大量的研究还证实,包括TMZ在内的传统化疗药物对胶质瘤干细胞的杀伤作用较弱[4]。Livin基因作为近年来新发现的抗凋亡家族成员,在肿瘤细胞增殖和细胞凋亡方面的作用日渐突出,而多重耐药蛋白(multidrug resistance protein,MRP)在肿瘤细胞化疗耐药发生机制方面则起着重要作用[5]。本研究应用免疫磁珠法分离胶质瘤TJ905干细胞,利用RNA干扰技术构建Livin-siRNA慢病毒转染模型,通过TMZ干预转染后的胶质瘤TJ905干细胞,检测沉默Livin基因后TJ905干细胞增殖、细胞周期及MRPl、MRP3基因表达情况,探讨Livin基因与多重耐药基因之间的关系,为进一步研究胶质瘤干细胞化疗耐药机制提供实验依据。
1 材料与方法 1.1 主要材料与试剂胎牛血清(FBS)购自杭州四季青公司;改良Eagle培养基(DMEM/F12) 购自美国HyClone公司;胰蛋白酶、PBS缓冲液、牛血清白蛋白(BSA)、乙二胺四乙酸(EDTA)购自美国Gibco公司;B27(50×)、表皮生长因子(EGF)、碱性成纤维细胞生长因子(bFGF)、白血病抑制因子(LIF)购自美国Peprotech公司;免疫磁珠细胞分选试剂盒购自德国Miltenyi Biotec公司;兔抗人Nestin抗体、兔抗人GFAP抗体和小鼠抗人β-tubulin抗体购自美国Santa Cruz公司;异硫氰酸荧光素(FITC)标记的羊抗兔IgG、羊抗小鼠IgG均购自武汉博士德生物技术有限公司。
1.2 胶质瘤TJ905细胞培养及其干细胞的分选选择生长状态良好的TJ905细胞,在含10% FBS的常规培养基中连续培养;利用免疫磁珠法分选、CD133+干细胞,将其置于含有EGF (20ng/ml)、bFGF (20ng/ml)、LIF (10ng/ml)和B27(1×)的无血清干细胞培养基中培养。
1.3 免疫荧光染色法鉴定胶质瘤干细胞及其诱导分化细胞将细胞球植入到10%多聚赖氨酸包被的玻片上,室温晾干后4%多聚甲醛固定30min,加入5%山羊血清封闭液,室温孵育30 min后加入一抗Nestin(1:200),湿盒内4℃过夜;次日PBS漂洗3遍后加入FITC标记二抗(1:50) 于湿盒内37℃避光孵育30min,同时用PBS代替荧光二抗作阴性对照,然后PBS冲洗后置于荧光显微镜下观察并拍照。取生长状态良好的细胞球植入预先经多聚赖氨酸包被好的6孔板中,用含10% FBS的DMEM/F12(1:1) 完全培养基培养3~6d,待细胞周围伸出较长突起或散在细胞变为多角形、星形或梭形,用上述类似方法将诱导后的细胞行胶质酸性蛋白(GFAP)和β-微管蛋白(β-Tubulin)免疫荧光检测。
1.4 慢病毒转染取生长状态良好的TJ9005干细胞接种于96孔板,分为干细胞实验组和对照组,每组20个孔,实验组转染携带siRNA的病毒20h,对照组转染空病毒。然后更换培养基,转染完成后37℃、5% CO2饱和湿度培养箱连续培养3d,倒置荧光显微镜下观察转染效果。预实验摸索TJ9005干细胞感染复数MOI值为10,根据慢病毒转染说明书进行操作。
1.5 CCK-8法检测细胞增殖按照实验设计分组,提前24h在96孔板接种TJ905干细胞,每孔各105个,24h吸掉96孔板培养基后每孔添加100μl不同浓度的TMZ培养基,TMZ浓度分别为0(空白对照组)、25、50、100、200、400μmol/L(空白对照为DMSO代替),每孔设2个副孔。TMZ干预72h后弃掉培养基,每孔加100μl CCK-8溶液(DME/F12:CCK-8=9:1),37℃温箱孵育2h,上机检测(检测波长450nm,参照波长630nm),每组重复2次。
1.6 流式细胞术检测干细胞周期按照上述实验设计分组TJ905干细胞制备成单细胞悬液,70%乙醇4℃固定过夜,次日PBS漂洗,添加500μl配制好的PI染色液,37℃孵育30min,4℃冰盒待检。采用流式细胞仪自带分析软件分析数据。
1.7 实时荧光定量PCR(RT-qPCR)检测分别用上述浓度的TMZ干预TJ905干细胞,并在干预72h后收集细胞,用TRIzol一步法提取总RNA,采用RT-PCR技术对逆转录扩增产物进行定量分析。PRIMER5.0设计Livin、MRPl、MRP3引物序列,引物序列信息如表 1。使用PrimeScript PLUS RTase将RNA反转录成cRNA。按照试剂盒说明书建立终体积为20μl的PCR反应体系,2μl反转录产物、10μlSYBR Green I、上下游引物(10μmol/L)各0.5μl。在反应过程中每次扩增的同时设无cDNA做阴性对照。获取各组标本的标准曲线结果分析采用荧光定量PCR仪器自带分析软件分析标本的Ct值。计算方法:待测样品相对值=2-ΔΔCt,ΔΔCt=Ct阴性对照-Ct待测样品。
| 表 1 PCR引物检测序列 |
实验数据应用IBM SPSS19.0软件进行分析,计量资料用x±s表示,RT-qPCR结果比较采用析因分析。以P<0.05为差异具有统计学意义。
2 结果 2.1 胶质瘤TJ905干细胞的分选与鉴定免疫磁珠法分选CD133+细胞,接种于无血清干细胞培养基,最初24~48h内细胞生长比较缓慢,3d后开始出现细胞球,至第6~8d左右细胞球显著增大。细胞球悬浮生长,大小不一,呈圆形或不规则规则球形,折光性较强。将胶质瘤TJ905干细胞球接种到经10%多聚赖氨酸包被的玻片上,室温晾干后行Nestin、GFAP、β-Tubulin免疫荧光染色,在荧光显微镜观察显示,干细胞球Nestin染色呈现为绿色荧光,而GFAP、β-Tubulin染色无绿色荧光;用完全培养基诱导分化3~5d后行Nestin、GFAP、β-Tubulin免疫荧光染色,结果显示胶质瘤TJ905干细胞球分化细胞Nestin染色呈阴性。见图 1。

|
图 1 TJ905干细胞分选与鉴定(免疫荧光染色,×200) 注:A.TJ905干细胞Nestin染色阳性;B.Nestin染色阴性对照;C.TJ905干细胞经含血清培养基诱导分化后GFAP染色阳性;D.TJ905干细胞经含血清培养基诱导分化后β-Tubulin染色阳性。 |
待转染完成,培养3d后于倒置荧光显微镜下观察干细胞转染情况,结果显示转染后的胶质瘤TJ905干细胞在镜下呈绿色荧光,慢病毒转染效率为80%。见图 2。

|
图 2 慢病毒转染TJ905干细胞前后对比(免疫荧光染色,×100) 注:A.对照组TJ905干细胞慢病毒转染前;B.对照组TJ905干细胞慢病毒转染后;C.实验组TJ905干细胞慢病毒转染前;D.实验组TJ905干细胞慢病毒转染后。 |
CCK-8检测结果显示:实验组TJ905干细胞的存活率随TMZ浓度的增加而下降,与对照组比较差异有统计学意义(P<0.05);且相同的药物浓度时,实验组干细胞存活率低于对照组,两者之间的差异有统计学意义(P<0.05)。见图 3。

|
图 3 CCK-8检测不同浓度TMZ干预实验组和对照组72h后的存活率变化 |
采用流式细胞仪检测细胞周期变化,结果显示:使用不同浓度的TMZ干预,实验组(91.44±1.29) 和对照组(77.67±1.49) 的细胞周期均停滞于G0/G1期,且实验组更加明显,差异具有统计学意义(P<0.05);随着TMZ浓度的增加,实验组与对照组干细胞S期所占比例逐渐增多,而G0/G1期逐渐减少,TMZ在0μmol时,S期在实验组(3.66±0.10) 和对照组(17.37±1.35),差异具有统计学意义(P<0.05),TMZ在400μmol时,S期在实验组(34.49±1.19) 和对照组(53.65±1.27),差异具有统计学意义(P<0.05)。见图 4。
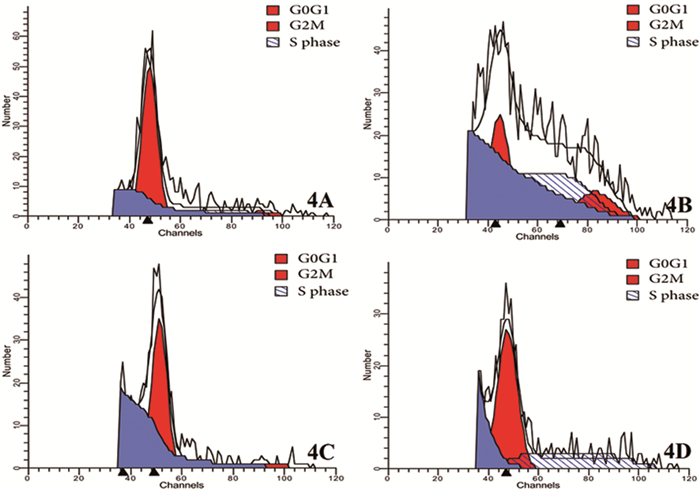
|
图 4 TMZ干预TJ905干细胞72h后细胞周期变化 注:A.0μmol/L TMZ干预对照组TJ905干细胞B.400μmol/L TMZ干预对照组TJ905干细胞C.0μmol/L TMZ干预实验组TJ905干细胞D.400μmol/L TMZ干预实验组TJ905干细胞 |
结果显示:TJ905干细胞Livin基因mRNA表达量分别为:实验组为(0.177±0.021)×10-4,对照组为(1.259±0.145)×10-4,差异有统计学意义(P<0.05)。在相同的药物浓度干预下,实验组MRP1和MRP3 mRNA表达量与对照组相比均下降,在各浓度时差异均有统计学意义(P<0.05);而在不同TMZ浓度干预下,各组中MRP1和MRP3 mRNA的表达也具有差异性(P<0.05)。见表 2、表 3。
| 表 2 不同浓度TMZ干预72h后实验组和对照组MRP1 mRNA表达量比较(μmol/L, x±s) |
| 表 3 不同浓度TMZ干预72h后实验组和对照组MRP3 mRNA表达量比较(μmol/L, x±s) |
胶质瘤是颅内最常见的原发性肿瘤,复发率高、预后差,患者在确诊后即使接受了积极的手术切除和放射、化学药物治疗后,胶质母细胞瘤患者的中位生存时间只有12~18个月[6]。以往的化疗药物是以胶质瘤细胞为研究对象的,而对胶质瘤干细胞作用较弱,不能产生有效的杀灭作用,这被认为是产生胶质瘤化疗耐药与胶质瘤复发的根源[7-9]。因此,以胶质瘤细胞为载体模型揭示化疗耐药作用机制有局限性,以胶质瘤干细胞为模型的研究才有可能最终揭示胶质瘤发生和化疗耐药的机制,才有可能研制出对胶质瘤干细胞敏感性高的治疗药物,从而实现对胶质瘤的治疗。
Livin基因是细胞凋亡抑制蛋白(IAP)家族的新成员,其在细胞增殖、细胞凋亡和细胞周期控制中发挥着关键作用。据报道,Livin基因的过表达和肿瘤细胞的细胞凋亡抗性表型密切相关,并且Livin基因也可以赋予对化疗药物的抗性[10-11]。通过前期研究也发现[12],Livin基因在胶质瘤干细胞中的表达量更高,且在TMZ浓度增至100 μmol/L时,胶质瘤干细胞增殖率的抑制作用明显低于胶质瘤细胞,说明胶质瘤干细胞比胶质瘤细胞更具耐药性[13]。我们课题组之前的研究结果显示,Livin基因在胶质瘤细胞和胶质瘤干细胞中过表达[14]。本文利用RNA干扰技术,沉默胶质瘤TJ905干细胞中Livin基因表达,应用胶质瘤一线化疗药物TMZ干预后发现实验组TJ905干细胞存活率明显低于对照组,细胞周期中G0/G1期所占比增多而S期所占比下降。提示沉默胶质瘤干细胞中Livin基因可以提高TMZ的杀伤效果,降低了干细胞对TMZ的化疗抵抗作用。结合前期研究内容[15],Livin-siRNA可能通过上调TNF-α基因的表达,促使化疗药物TMZ对胶质瘤TJ905干细胞TNF-α的表达产生诱导作用,降低了胶质瘤TJ905干细胞的化疗耐药,然而胶质瘤干细胞介导的化疗耐药途径还不甚清楚。
多重耐药是导致肿瘤患者化疗失败的主要原因,而导致多重耐药的重要机制之一是MRP的表达增加,MRP属于ABC转运蛋白超家族成员,它可以降低肿瘤细胞对药物的敏感性,导致细胞耐药的产生。其中,对MRP1的作用进行的研究表明,抑制其活性已经成为在化疗中逆转多重耐药性的有效工具[16]。MRP3与MRP1具有相似的结构,相反的是,在正常脑组织中没有MRP3的表达。在mRNA和蛋白质水平,过表达MRP3具有评价患者预后的潜在价值和作为免疫治疗的靶向目标[15]。另外,MRP1和MRP3在胶质瘤干细胞中的表达量明显高于胶质瘤细胞,并且应用化疗药物干预后,MRP1的表达量明显升高,说明MRP1可能在胶质瘤干细胞化疗耐药中发挥更大的作用[16],目前只有少数有关特别是高级别脑肿瘤相关的MRP1或MRP3的活性与化学抗性的研究。
本文发现对照组随着TMZ浓度的增大,MRP1表达水平上升,MRP3表达水平却出现先上升后下降;而实验组中MRP1、MRP3的表达量均低于对照组,在TMZ高浓度时作用尤为突出。结果说明MRP1和MRP3的表达水平可能与Livin密切相关,通过靶向沉默Livin可有效降低MRP1和MRP3的表达。但是,对照组MRP3表达水平却出现先上升后下降,可能是因为胶质瘤TJ905干细胞中MRPl和MRP3的具有不同的表达特点,使胶质瘤干细胞在胶质瘤治疗的不同阶段发挥不完全相同的作用[17]。
总之,Livin-siRNA能有效降低胶质瘤TJ905干细胞中MRP1、MRP3基因的表达水平,并能显著抑制胶质瘤TJ905干细胞的增殖,表明MRP1、MRP3的高表达可能与Livin基因密切相关。因此,利用Livin-siRNA可以逆转胶质瘤TJ905干细胞对化疗药物的耐药性,可能会成为新的胶质瘤治疗靶点,有待在今后研究中进一步证实。
| [1] | Sharma A, Shiras A. Cancer stem cell-vascular endothelial cell interactions in glioblastoma[J]. Biochem Biophys Res Commun, 2016, 473(3): 688–692. DOI:10.1016/j.bbrc.2015.12.022 |
| [2] | Jin F, Zhang R, Feng S, et al. Pathological features of transplanted tumor established by CD133 positive TJ905 glioblastoma stem-like cells[J]. Cancer Cell International, 2015, 15(1). DOI:10.1186/s12935-015-0208-y |
| [3] | Liebelt BD, Shingu T, Zhou X, et al. Glioma Stem Cells:Signaling, Microenvironment, and Therapy[J]. Stem Cells Int, 2016, 2016: 7849890. DOI:10.1155/2016/7849890 |
| [4] | Srensen MD, Fosmark S, Hellwege S, et al. Chemoresistance and chemotherapy targeting stem-like cells in malignant glioma[J]. Adv Exp Med Biol, 2015, 853: 111–138. DOI:10.1007/978-3-319-16537-0_7 |
| [5] | Zhang YK, Wang YJ, Gupta P, et al. Multidrug Resistance Proteins (MRPs) and Cancer Therapy[J]. AAPS J, 2015, 17(4): 802–812. DOI:10.1208/s12248-015-9757-1 |
| [6] | Paw I, Carpenter RC, Watabe K, et al. Mechanisms regulating glioma invasion[J]. Cancer Lett, 2015, 362(1): 1–7. DOI:10.1016/j.canlet.2015.03.015 |
| [7] | Garrido W, Rocha JD, Jaramillo C, et al. Chemoresistance in high-grade gliomas:relevance of adenosine signalling in stem-like cells of glioblastoma multiforme[J]. Curr Drug Targets, 2014, 15(10): 931–942. |
| [8] | 高谋, 徐如祥, 杨志军. 干细胞在胶质瘤治疗中的研究进展[J]. 中华神经医学杂志, 2014, 13(5): 531–533. DOI:10.3760/cma.j.issn.1671-8925.2014.05.022 |
| [9] | 李根华, 冯嵩, 刘阳, 等. 替莫唑胺对胶质瘤干细胞抗凋亡与多重耐药基因及细胞周期的影响[J]. 中华神经外科杂志, 2015, 31(7): 727–731. DOI:10.3760/cma.j.issn.1001-2346.2015.07.020 |
| [10] | Wang X, Xu J, Ju S, et al. Livin gene plays a role in drug resistance of colon cancer cells[J]. Clin Biochem, 2010, 43(7-8): 655–660. DOI:10.1016/j.clinbiochem.2010.02.004 |
| [11] | Shao SL, Cui TT, Zhao W, et al. RNAi-based knockdown of multidrug resistance-associated protein 1 is sufficient to reverse multidrug resistance of human lung cells[J]. Asian Pac J Cancer Prev, 2014, 15(24): 10597–10601. DOI:10.7314/apjcp.2014.15.24.10597 |
| [12] | Liu Y, Guo Q, Zhang H, et al. Effect of siRNA-Livin on drug resistance to chemotherapy in glioma U251 cells and CD133(+) stem cells[J]. Exp Ther Med, 2015, 10(4): 1317–1323. DOI:10.3892/etm.2015.2675 |
| [13] | 李根华, 张浩, 刘阳, 等. 替莫唑胺对U251干细胞细胞周期及细胞增殖的影响[J]. 济宁医学院学报, 2013, 36(3): 166–170. DOI:10.3969/j.issn.1000-9760.2013.03.004 |
| [14] | Jin F, Zhao L, Guo YJ, et al. Influence of Etoposide on anti-apoptotic and multidrug resistance-associated protein genes in CD133 positive U251 glioblastoma stem-like cells[J]. Brain Res, 2010, 1336: 103–111. DOI:10.1016/j.brainres.2010.04.005 |
| [15] | 刘洋, 郭强, 张浩, 等. Livin靶向siRNA对胶质瘤TJ905干细胞及肿瘤坏死因子-α的影响[J]. 临床荟萃, 2015, 30(3): 312–314. |
| [16] | Peigan L, Garrido W, Segura R, et al. Combined use of anticancer drugs and an inhibitor of multiple drug resistance-associated protein-1 increases sensitivity and decreases survival of glioblastoma multiforme cells in vitro[J]. Neurochem Res, 2011, 36(8): 1397–1406. DOI:10.1007/s11064-011-0464-8 |
| [17] | Kuan C T, Wakiya K, Herndon J E, et al. MRP3:a molecular target for human glioblastoma multiforme immunotherapy[J]. BMC Cancer, 2010, 10(1): 468. DOI:10.1186/1471-2407-10-468 |



