2. 广东华曦法医物证司法鉴定所, 深圳 518000
2. Guangdong Huaxi Forensic Institute of Judicial Expertise, Shenzhen 518000, China
氯胺酮是目前临床常用的全身麻醉药,因其强烈的致幻觉及致欣快作用,自20世纪90年代起氯胺酮作为一种新型毒品在我国迅速引起广泛性滥用。过去研究表明,氯胺酮滥用者可出现一系列神经毒性反应及行为学改变。健康受试者在静脉注射氯胺酮1min后便开始出现学习记忆能力下降及难以集中注意力等变化,这一影响通常持续30~60min,但受试者出现的轻微幻觉可长达24h[1]。
单羧酸转运蛋白(monocarboxylate transporter, MCTs)是一种存在于细胞膜表面的介导乳酸跨膜转运的蛋白,脑内主要包含MCT1、MCT2、MCT4三种亚型,其中MCT1、MCT4特异性表达于星形胶质细胞,MCT2特异性表达于神经元。乳酸是脑内主要的能源物质,尤其在执行神经活动、神经细胞损伤等特殊情况下,乳酸在神经胶质细胞和神经元间的传递对于神经元活性维持、受损神经元修复及大脑功能行使必不可少。研究发现,MCT1、MCT2、MCT4在细胞膜上表达水平的变化可以影响乳酸转运过程,改变脑内的能量代谢情况,进而引起神经功能改变[2]。
本文拟进行氯胺酮单次注射,采取Western blot方法检测小鼠海马区MCT1、MCT2和MCT4蛋白表达变化,探讨氯胺酮的神经毒性作用与乳酸转运障碍之间的可能关系。
1 材料和方法 1.1 材料 1.1.1 实验动物3月龄健康雄性C57BL/6小鼠40只,体质量25~30g,由中国医科大学实验动物中心提供。
1.1.2 药品、试剂及仪器兔抗小鼠MCT1多克隆抗体(美国Santa Cruz公司,sc-50325)、小鼠抗小鼠MCT2单克隆抗体(美国Santa Cruz公司,sc-166925)、兔抗小鼠MCT4单克隆抗体(美国Santa Cruz公司,sc-50329)、小鼠抗小鼠GAPDH单克隆抗体(中山金桥生物技术公司,TA-08)、细胞膜蛋白与浆蛋白提取试剂盒(碧云天)等。
1.2 方法 1.2.1 动物模型建立及分组将小鼠随机分为saline组和ket 1、ket 2、ket 3、ket 4组,每组8只,分别腹腔注射生理盐水及10、20、40、80mg/kg氯胺酮,给药后6h取材。
1.2.2 Western blot检测分离小鼠海马,提取海马胞膜蛋白,对MCT1、MCT2和MCT4进行蛋白定量检测。15μg蛋白等量上样,SDS-PAGE凝胶电泳后,湿膜法转印至PVDF膜,经8%脱脂奶粉室温封闭2.5h后加入兔抗小鼠多克隆抗体MCT1(1:300稀释)、小鼠抗小鼠单克隆抗体MCT2(1:300稀释)和兔抗小鼠多克隆抗体MCT4(1:300稀释)4℃孵育过夜。TBST洗膜,加入相应的二抗室温1h,TBST洗膜后ECL发光。利用Scion Image软件分别检测MCT1、MCT2、MCT4和GAPDH蛋白表达的平均光密度值,分别用MCT1、MCT2、MCT4与GAPDH相比,得到对应指标蛋白表达相对量。
1.3 统计学方法采用SPSS22.0 for Windows软件进行统计学分析,数据用x± s来表示,总体差异采用方差分析,并运用LSD-t法进行事后两两比较,P≤0.05为差异有统计学意义。
2 结果 2.1 各组小鼠海马组织MCT1表达结果MCT1片段大小为43kDa,各ket组MCT1蛋白表达相对量较saline组蛋白表达相对量降低(P < 0.05,P < 0.01),不同剂量组间无统计学差异。见图 1。

|
图 1 各组海马组织中MCT1的表达 注:5组间比较,F=8.737,P < 0.0001;与saline组比较, *P < 0.05,**P < 0.01 |
MCT2片段大小为45kDa,ket 3组、ket 4组MCT2蛋白表达相对量较saline组蛋白表达相对量升高,氯胺酮ket 1组及ket 2组较saline组无明显变化(P < 0.01),组间无统计学差异。见图 2。
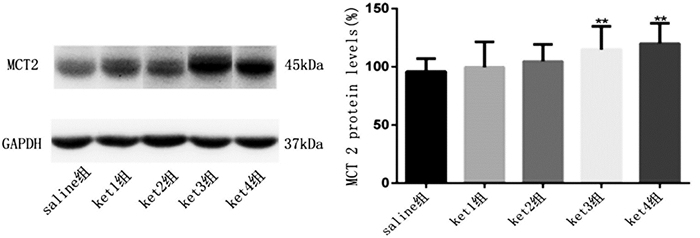
|
图 2 各组海马组织中MCT2的表达 注:5组间比较,F=3.763,P=0.0093;与saline组比较, **P < 0.01 |
MCT4片段大小为43kDa,各ket组MCT4蛋白表达相对量较saline组蛋白表达相对量降低(P < 0.01),不同剂量组间无统计学差异。见图 3。
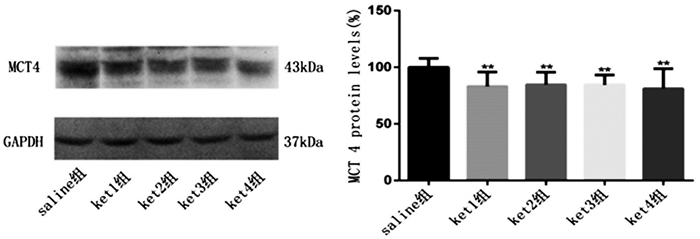
|
图 3 各组海马组织中MCT4的表达 注:5组间比较,F=4.565,P=0.0050;与saline组比较, **P < 0.01 |
氯胺酮为非竞争性N-甲基-D-天门冬氨酸(N-methyl-D-aspartate, NMDA)受体拮抗剂,广泛应用于临床麻醉,同时也是我国近年来最常见的滥用物质之一。研究发现,氯胺酮短期注射会导致前额叶及海马区神经细胞变性、凋亡,且损伤有一定的剂量-效应关系[3-4]。Duan等[5]以30mg/kg氯胺酮注射SD大鼠1h后,进行行为学实验,发现其在水迷宫中表现出明显的空间参考记忆的损伤,同时电生理结果显示大鼠海马区出现了可逆性突触功能减弱。但也有文献报道,分别以25、70及150mg/kg单次注射氯胺酮并未引起小鼠神经细胞凋亡增加;注射后1、2、3d分别进行行为学实验,均无异常表现[6]。本课题组前期行为学实验显示,C57BL/6小鼠随机分组,分别接受腹腔单次注射10、20、40、80mg/kg氯胺酮后3h时开始行为学实验,与生理盐水组相比,氯胺酮处理组小鼠在旷场实验及Y迷宫中的表现并未出现明显改变。提示不同剂量氯胺酮单次注射3h后,对小鼠的行为及认知功能未造成影响[7]。分析本实验组与之前研究结果不同的原因可能与实验动物及行为学测试时间等方面不同。
近年来,大量研究发现乳酸是大脑所需能量的主要来源[8]。乳酸在星形胶质细胞内产生后,经其胞膜上的MCT1、MCT4转出至细胞间隙,随后由特异性表达于神经细胞膜上的MCT2摄取、转至胞内为进一步神经活动提供能量,这一经MCTs介导的乳酸转运是维持神经细胞活性及行使大脑功能的必备环节[9-10]。Schurr等[11]通过对短暂性大脑缺血大鼠模型的研究发现,腹腔注射4-CIN抑制MCT2表达后,大鼠脑损伤区域范围明显增加、损伤程度加重,提示MCT对于大脑活性的维持及损失后修复的重要意义。此外,有研究发现海马内注射4-CIN后,SD大鼠记忆功能受到严重影响,且这种影响可以被乳酸缓解,提示记忆功能与MCT介导乳酸转运息息相关[12]。Lu等[13]发现,与对照组相比,AD模型大鼠在水迷宫实验中明显表现出记忆功能受损,同时发现实验组脑皮质及海马区乳酸水平均显著降低,MCT 2的表达也显著减少,这一结果也提示MCT在记忆功能中的重要作用。
本实验通过氯胺酮单次注射,Western bolt检测小鼠海马胞膜蛋白发现,表达于星形胶质细胞膜的MCT1、MCT4蛋白在氯胺酮组的蛋白表达相对量均较生理盐水组蛋白表达相对量低,且差异有统计学意义,但各实验组间差异无统计学意义;而表达于神经元胞膜的MCT2蛋白表达量仅在ket 3组和ket 4组有统计学变化,呈升高趋势。以上实验结果说明,氯胺酮单次注射在10~80mg/kg剂量中均可致海马区星形胶质细胞膜上MCT1和MCT4表达下降。与MCT1和MCT4相比,MCT2对氯胺酮的反应存在剂量效应,从40mg/kg才开始引起蛋白表达改变,且趋势与MCT1、MCT4相反,由此我们推测MCT2表达变化可能是由于氯胺酮作用引起MCT1、MCT4在星形胶质细胞胞膜上表达下降,引起乳酸的星形胶质细胞-神经元转运障碍,进而机体反应性上调神经元胞膜上MCT2的表达,增加进入神经元的乳酸量,维持神经元的能量代谢及正常的生理活动。
脑是机体主要的耗能器官,能量代谢对于维持神经细胞的活性及功能必不可少。对AD患者的研究发现,其脑内能量的摄取及利用障碍较其组织学及行为学改变更早出现[14]。我们发现氯胺酮单次注射虽不引起明显的行为学异常,但氯胺酮组小鼠海马区MCT1、MCT4表达下降,MCT2表达升高,提示即使单次使用氯胺酮也可影响海马区乳酸转运,引起能量代谢异常,这一变化为进一步探讨氯胺酮的神经毒性作用与乳酸转运、能量代谢之间的可能关系,阐明氯胺酮滥用所致认知功能障碍的机制提供有益的数据。
| [1] | Pfenninger EG, Durieux ME, Himmelseher S. Cognitive impairment after small-dose ketamine isomers in comparison to equianalgesic racemic ketamine in human volunteers[J]. Anesthesiology, 2002, 96(2): 357–366. DOI:10.1097/00000542-200202000-00022 |
| [2] | Suzuki A, Stern SA, Bozdagi O, et al. Astrocyte-neuron lactate transport is required for long-term memory formation[J]. Cell, 2011, 144(5): 810–823. DOI:10.1016/j.cell.2011.02.018 |
| [3] | Zuo D, Lin L, Liu Y, et al. Baicalin attenuates ketamine-induced neurotoxicity in the developing rats: involvement of PI3K/Akt and CREB/BDNF/Bcl-2 pathways[J]. Neurotox Res, 2016, 30(2): 159–172. DOI:10.1007/s12640-016-9611-y |
| [4] | Liu F, Paule MG, Ali S, et al. Ketamine-induced neurotoxicity and changes in gene expression in the developing rat brain[J]. Curr Neuropharmacol, 2011, 9(1): 256–261. DOI:10.2174/157015911795017155 |
| [5] | Duan TT, Tan JW, Yuan Q, et al. Acute ketamine induces hippocampal synaptic depression and spatial memory impairment through dopamine D1/D5 receptors[J]. Psychopharmacology (Berl), 2013, 228(3): 451–461. DOI:10.1007/s00213-013-3048-2 |
| [6] | Ribeiro PO, Rodrigues PC, Valentim AM, et al. A single intraperitoneal injection of ketamine does not affect spatial working, reference memory or neurodegeneration in adult mice: An animal study[J]. Eur J Anaesthesiol, 2013, 30(10): 618–626. DOI:10.1097/EJA.0b013e3283610321 |
| [7] | Li Y, Shen R, Wen G, et al. Effects of Ketamine on levels of inflammatory cytokines IL-6, IL-1β, and TNF-α in the hippocampus of mice following acute or chronic administration[J]. Frontiers in Pharmacology, 2017: 8. DOI:10.3389/fphar.2017.00139 |
| [8] | Boumezbeur F, Petersen KF, Cline GW, et al. The contribution of blood lactate to brain energy metabolism in humans measured by dynamic 13C nuclear magnetic resonance spectroscopy[J]. J Neurosci, 2010, 30(42): 13983–13991. DOI:10.1523/JNEUROSCI.2040-10.2010 |
| [9] | Bélanger M, Allaman I, Magistretti PJ. Brain energy metabolism:focus on astrocyte-neuron metabolic cooperation[J]. Cell Metab, 2011, 14(6): 724–738. DOI:10.1016/j.cmet.2011.08.016 |
| [10] | Gibbs ME, Lloyd HG, Santa T, et al. Glycogen is a preferred glutamate precursor during learning in 1-day-old chick:biochemical and behavioral evidence[J]. J Neurosci Res, 2007, 85(15): 3326–3333. DOI:10.1002/jnr.21307 |
| [11] | Schurr A, Payne RS, Miller JJ, et al. Blockade of lactate transport exacerbates delayed neuronal damage in a rat model of cerebral ischemia[J]. Brain Res, 2001, 895(1-2): 268–272. DOI:10.1016/s0006-8993(01)02082-0 |
| [12] | Newman LA, Korol DL, Gold PE. Lactate produced by glycogenolysis in astrocytes regulates memory processing[J]. PLoS One, 2011, 6(12): e28427. DOI:10.1371/journal.pone.0028427 |
| [13] | Lu W, Huang J, Sun S, et al. Changes in lactate content and monocarboxylate transporter 2 expression in Aβ-treated rat model of Alzheimer's disease[J]. Neurol Sci, 2015, 36(6): 871–876. DOI:10.1007/s10072-015-2087-3 |
| [14] | Pierre K, Pellerin L. Monocarboxylate transporters in the central nervous system:distribution, regulation and function[J]. J Neurochem, 2005, 94(1): 1–14. DOI:10.1111/j.1471-4159.2005.03168.x |




 吴旭, 医学博士、美国哈佛大学医学院麻省总医院博士后, 教授, 博士研究生导师, 现任中国医科大学法医学院党总支书记兼副院长。参加编写全国高等医学院校法医学专业规划教材《法医毒理学》第4版及第5版、《法医学》(第2版)、创新教材《法医学》(第1版)。参加编写专业著作《实用法医学》(第1版)、《法医学辞典》(第1版)。在国际及国家级专业学术期刊发表论文70余篇, 其中SCI文章10余篇。承担国家自然科学基金面上项目2项, 辽宁省自然科学基金项目2项、辽宁省教育厅科学研究一般项目1项、市级课题2项, 参加国家自然基金及省市各类课题多项, 目前主要从事毒麻药品中枢神经系统损害及颅脑损伤分子病理学机制等方面的研究。获辽宁省科技进步三等奖、沈阳市科技进步三等奖各1项。除科研、教学及培养研究生等工作外, 还承担和参加省内外司法机关和医疗卫生行政部门委托的法医病理学、法医毒理学鉴定工作, 并多次被邀请参加省内外疑难案件的法医学鉴定
吴旭, 医学博士、美国哈佛大学医学院麻省总医院博士后, 教授, 博士研究生导师, 现任中国医科大学法医学院党总支书记兼副院长。参加编写全国高等医学院校法医学专业规划教材《法医毒理学》第4版及第5版、《法医学》(第2版)、创新教材《法医学》(第1版)。参加编写专业著作《实用法医学》(第1版)、《法医学辞典》(第1版)。在国际及国家级专业学术期刊发表论文70余篇, 其中SCI文章10余篇。承担国家自然科学基金面上项目2项, 辽宁省自然科学基金项目2项、辽宁省教育厅科学研究一般项目1项、市级课题2项, 参加国家自然基金及省市各类课题多项, 目前主要从事毒麻药品中枢神经系统损害及颅脑损伤分子病理学机制等方面的研究。获辽宁省科技进步三等奖、沈阳市科技进步三等奖各1项。除科研、教学及培养研究生等工作外, 还承担和参加省内外司法机关和医疗卫生行政部门委托的法医病理学、法医毒理学鉴定工作, 并多次被邀请参加省内外疑难案件的法医学鉴定