2. 济宁医学院附属济宁市第一人民医院, 济宁 272011
2. Jining First People's Hospital & the Affiliated Hospital of Jining Medical University, Jining 272011, China
卵巢癌的发病率居妇科肿瘤的第二位,死亡率居第一位[1]。虽然卵巢癌近些年来的研究取得了很多进展,但卵巢癌生存率仍是极低的。1994年瘦素 (Leptin) 被发现[2],1995年成功克隆OBR基因。研究表明,Leptin及其受体参与某些恶性肿瘤的发生、发展过程,如子宫颈癌[3]、乳腺癌[4]、胰腺癌[5]等。我们在之前也研究过Leptin及OBR在乳头状甲状腺癌中的作用[6]。本文旨在卵巢癌中Leptin和OBR的表达和临床病理特征之间的关系,为诊断、治疗卵巢癌提供新的方法,为卵巢癌的基础研究提供新的理论依据。
1 资料与方法 1.1 一般资料济宁医学院附属济宁市第一人民医院病理科2012~2015年卵巢癌组织标本102例,并收集相对应的临床病理特征资料。
1.2 试剂与材料Leptin多克隆抗体Leptin (A20) 及OBR多克隆抗体Ob-R (M18) 均购自Santa Cruz公司 (sc-1834);GTVisionTM Ⅲ抗鼠兔通用型免疫组化检测试剂盒购自上海鲁汶生物科技有限公司 (GK500705、GK500710、GK500711)。柠檬酸抗原修复液 (Ph6.0) 购自福州迈新生物技术开发有限公司 (MVS-0100/0101)。
1.3 免疫组化石蜡切片,厚约4μm。方法步骤:1) 二甲苯脱蜡,乙醇梯度水化,PBS清洗;2) 在Ph6.0的柠檬酸缓冲液中煮10min进行抗原修复,冷却至室温,PBS清洗;3) 过氧化物酶阻断剂37℃孵育10min后PBS清洗;4) 一抗4℃过夜,PBS清洗;5) 试剂A室温下孵育30min后PBS清洗;6) DAB工作液,光镜下控制显色;7) 苏木素复染,脱水,封片。以PBS代替一抗做空白对照。
1.4 结果判定阳性信号为棕黄色,主要位于细胞膜和胞质。每例免疫组化染色的切片由两位有经验的临床病理医师对染色结果进行判读,综合累积高倍镜下阳性细胞百分率评分和染色强度评分。1) 按染色强度评分:阴性者为0分,弱阳性者为1分,中等阳性者为2分,强阳性者为3分。2) 按阳性细胞百分率评分:高倍视野下观察每张切片随机选取10个视野,计数500个肿瘤细胞,计算每张切片中阳性肿瘤细胞占总计数肿瘤细胞的百分比。≤5%为0分,5%~25%为1分,25%~50%为2分,>50%为3分。3) 染色强度和阳性细胞百分率乘积积分≤1分为阴性 (-),2~3分为 (﹢),4~6分为 (++),6分以上为 (+++)。
1.5 统计学方法应用SPSS 16.0统计软件,对实验数据进行统计学分析。
2 结果 2.1 Leptin和OBR表达情况Leptin和OBR主要表达在卵巢癌组织中的细胞膜和 (或) 胞质中 (图 1~4)。Leptin和OBR在卵巢癌组织中的阳性表达率分别为71.57%(73/102) 和66.67%(68/102)。而Leptin与OBR阳性率差异无统计学意义 (P>0.05)。见表 1。
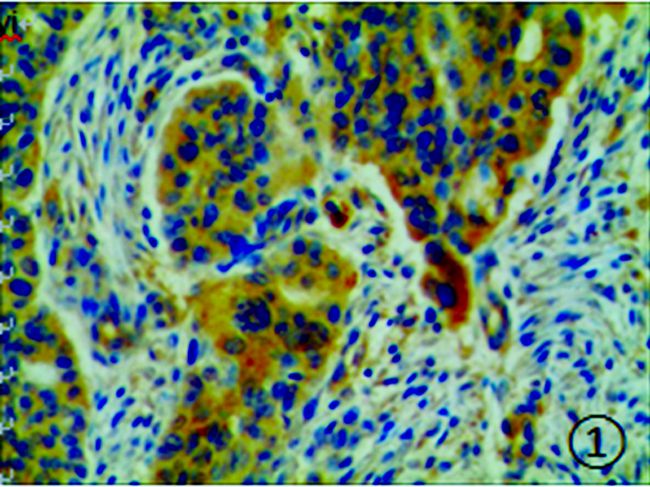
|
图 1 卵巢癌组织中Leptin的阳性表达 (HE染色,×200) |
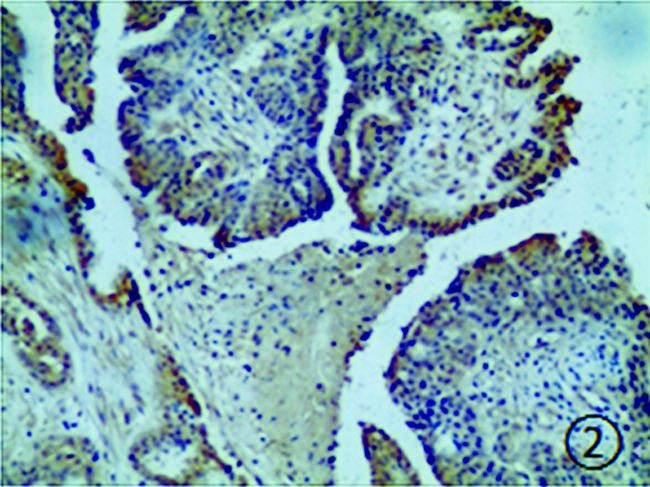
|
图 2 卵巢癌组织中OBR的阳性表达 (HE染色,×200) |
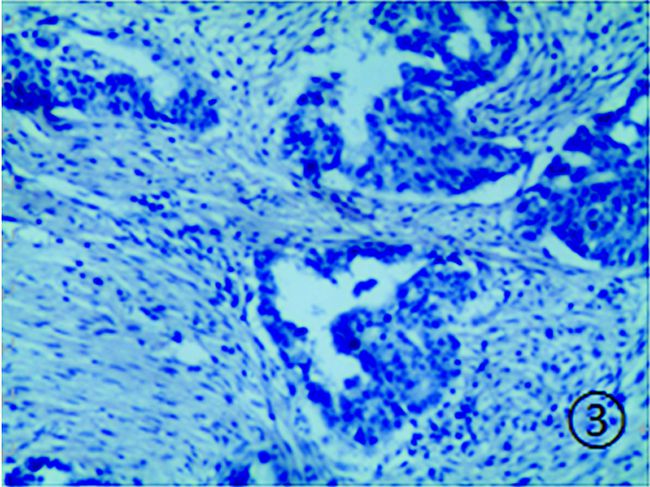
|
图 3 卵巢癌组织中Leptin的阴性表达 (HE染色,×200) |
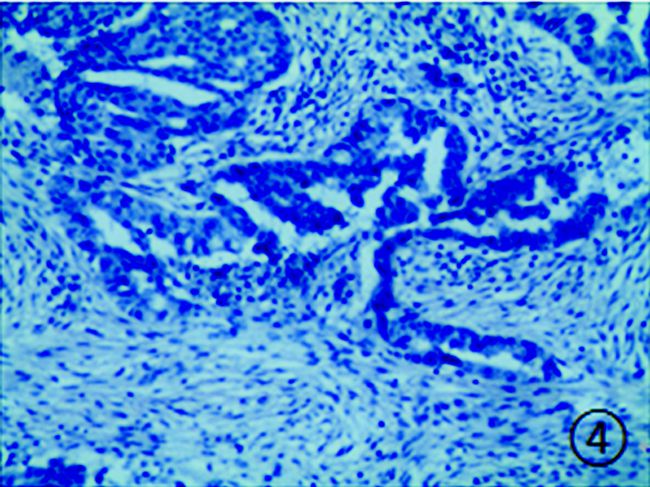
|
图 4 卵巢癌组织中OBR的阴性表达 (HE染色,×200) |
| 表 1 在卵巢癌中Leptin与OBR表达之间的关系 |
结果显示Leptin和OBR表达与患者年龄、转移、复发和绝经情况无关 (P>0.05)。在卵巢癌组织中LeptinB阳性表达和OBR阳性表达者的肿块直径均大于对应阴性表达者,差别有统计学意义 (P<0.05), Leptin阳性表达与卵巢癌TNM分期有关,Ⅱ/Ⅲ期的Leptin阳性表达率高于Ⅰ期 (P<0.05)。见表 2。
| 表 2 102例卵巢癌组织中Leptin和OBR表达的临床病理特征比较 |
结果显示在Leptin阳性表达时,OBR阳性的肿瘤直径大小明显大于OBR阴性。另外发现无论Leptin阳性表达与否,OBR的表达与肿瘤分期有关 (P<0.05)。见表 3。
| 表 3 Leptin与OBR相互作用及临床病理特征分析 |
近年来肥胖的发生率越来越高,使其成为一个重要的医学和社会问题。有研究表明肥胖增加卵巢癌患病率的风险[7]。Mendez-Lopez等[8]曾研究得到OBR在卵巢癌的血清和组织中的表达明显高于子宫内膜癌和正常人群。本文结果显示Leptin和OBR在卵巢癌中的阳性率分别为71.57%(73/102) 和66.67%(68/102),均提示Leptin和OBR在卵巢癌中高表达。另外在我们结果显示,Leptin及其受体共同表达率为50%。虽然Leptin与其受体之间的表达没有明显的统计学意义,但在其他肿瘤中两者的共同表达存在着联系,如在乳头状甲状腺癌中[8]。Lu研究认为Leptin的表达可以作为判断卵巢癌的候选血清标志物[9],尤其在2型卵巢癌中更为明显。
本文结果显示在卵巢癌中Leptin和OBR的表达均与肿瘤大小有关。一些研究者在其他肿瘤研究中表明Leptin可能促进肿瘤增殖和抑制细胞凋亡,也证实了Leptin及其受体与某些分子和机制有关[10]。Kato等[11]在卵巢癌细胞系中研究发现Leptin可以刺激细胞的迁移、浸润,并维护细胞的肿瘤特性。
研究还发现Leptin的表达与卵巢癌的肿瘤分期有关。在Ⅱ/Ⅲ期中Leptin的表达明显高于Ⅰ期。Grabowskiz[12]也在卵巢癌患者中研究得到血清中Leptin在高分化与低分化肿瘤之间的表达有明显差异。另外,Grabowskiz还发现在第1次化疗后血清中Leptin表达降低,可能影响患者的预后和生存。Uddin[13]发现OBR的高表达与卵巢癌的低生存率有关。
本文进一步证实Leptin和OBR在卵巢癌中的表达,并且证明了Leptin和OBR表达与肿瘤的大小相关,与肿瘤分期有关,为探明Leptin和OBR在卵巢癌的作用机制提供了新的理论依据。Leptin可能成为诊断肿瘤、治疗和评估预后的新的靶点或标志物。
| [1] | Jemal A, Siegel R, Xu J, et al. Cancer statistics, 2010[J]. CA Cancer J Clin, 2010, 60(5): 277–300. DOI:10.3322/caac.20073 |
| [2] | Zhang Y, Proenca R, Maffei M, et al. Positional cloning of the mouse obese gene and its human homologue[J]. Nature, 1994, 372(6505): 425–432. DOI:10.1038/372425a0 |
| [3] | 袁勇, 王晓敏, 陆建荣, 等. Leptin对子宫颈癌Hela细胞生物学行为的影响及机制[J]. 临床与实验病理学杂志, 2012, 28(2): 162–165. DOI:10.3969/j.issn.1001-7399.2012.02.012 |
| [4] | Tessitore L, Vizio B, Pesola D, et al. Adipocyte expression and circulating levels of leptin increase in both gynaecological and breast cancer patients[J]. Int J Oncol, 2004, 24(6): 1529–1535. |
| [5] | Stolzenberg-Solomon RZ, Newton CC, Silverman DT, et al. Circulating leptin and risk of pancreatic cancer:a pooled analysis from 3 cohorts[J]. Am J Epidemiol, 2015, 182(3): 187–197. DOI:10.1093/aje/kwv041 |
| [6] | 侯森, 崔文, 张国安, 等. OBR在甲状腺乳头状癌中的表达与临床关系研究[J]. 济宁医学院学报, 2012, 35(6): 402–404. |
| [7] | Protani MM, Nagle CM, Webb PM. Obesity and ovarian cancer survival:a systematic review and meta-analysis[J]. Cancer Prev Res (Phila), 2012, 5(7): 901–910. DOI:10.1158/1940-6207.CAPR-12-0048 |
| [8] | Méndez-López LF, Dávila-Rodríguez MI, Zavala-Pompa A, et al. Expression of leptin receptor in endometrial biopsies of endometrial and ovarian cancer patients[J]. Biomed Rep, 2013, 1(4): 659–663. DOI:10.3892/br.2013.125 |
| [9] | Lu D, Kuhn E, Bristow RE, et al. Comparison of candidate serologic markers for type Ⅰ and type Ⅱ ovarian cancer[J]. Gynecol Oncol, 2011, 122(3): 560–566. DOI:10.1016/j.ygyno.2011.05.039 |
| [10] | Stattin P, Sderberg S, Hallmans G, et al. Leptin is associated with increased prostate cancer risk:a nested case-referent study[J]. J Clin Endocrinol Metab, 2001, 86(3): 1341–1345. DOI:10.1210/jcem.86.3.7328 |
| [11] | Kato S, Abarzua-Catalan L, Trigo C, et al. Leptin stimulates migration and invasion and maintains cancer stem-like properties in ovarian cancer cells:an explanation for poor outcomes in obese women[J]. Oncotarget, 2015, 6(25): 21100–21119. DOI:10.18632/oncotarget.4228 |
| [12] | Grabowski J P, Markowska A, Markowska J. Evaluation of leptin serum concentrations during surgery and first-line chemotherapy in primary epithelial ovarian cancer patients[J]. Wspóczesna Onkologia, 2014, 5: 318–322. DOI:10.5114/wo.2014.46323 |
| [13] | Uddin S, Bu R, Ahmed M, et al. Overexpression of leptin receptor predicts an unfavorable outcome in Middle Eastern ovarian cancer[J]. Mol Cancer, 2009, 8(1): 74. DOI:10.1186/1476-4598-8-74 |



