前列腺素E1(prostaglandin E1, PGE1),为二十碳不饱和羟基脂肪酸的衍生物,属天然前列腺素类物质。具有舒张血管,改善微循环,细胞保护,抑制血小板聚集活化、炎症细胞浸润及免疫复合物形成等作用。临床用于心脑血管病等疾病的治疗[1]。以往研究证明,PGE1对脑缺血-再灌注损伤具有保护作用,能够减轻脑水肿,缩小脑梗死体积、改善脑损伤的病理形态变化;抑制脂质过氧化反应,降低MDA的含量,增强SOD、GSH-Px及ATP酶的活力;减少TNF-α和IL-1β生成等[2-3], 但其保护机制尚未完全清楚。目前认为,细胞凋亡在脑缺血-再灌注损伤的发生发展过程中起着重要作用,其凋亡过程又受多种基因的调控。本实验通过建立大鼠全脑缺血-再灌注模型,观察PGE1对脑缺血-再灌注损伤后神经细胞凋亡及促凋亡基因Caspase-3表达的影响,进一步探讨PGE1的脑保护作用机制,为PGE1防治脑缺血-再灌注损伤提供实验依据。
1 材料与方法 1.1 材料 1.1.1 实验动物健康雄性Wistar大鼠,体质量250~300g,购自郑州市惠济区华兴实验动物养殖场,许可证号:410108600026354。
1.1.2 药品、试剂及仪器前列腺素E1(沈阳市生物化学制药厂);免疫组化试剂盒 (武汉博士德生物工程有限公司)、DAB显色剂〔基因科技 (上海) 股份有限公司〕;Leica RM2235切片机 (德国Leica公司);光学显微镜 (日本Olympus公司);电热恒温烤箱 (上海跃进医疗器械)。
1.2 方法 1.2.1 实验动物分组与给药将Wistar大鼠随机分为假手术组、缺血-再灌模型组、PGE1组 (12μg/kg),每组8只。PGE1粉针剂溶于生理盐水中,于阻断血流前5mins经阴茎静脉开始滴入,持续2h。假手术组和模型组均于相同时间段由阴茎静脉滴入同容积的生理盐水。
1.2.2 大鼠全脑缺血-再灌注模型的制备及取材取雄性大鼠称重,用10%, 水合氯醛 (350mg.kg-1) 麻醉后, 仰卧固定于大鼠手术板上, 剪毛、消毒、钝性分离暴露双侧颈总动脉, 用无创伤性动脉夹同时夹闭双侧颈总动脉,阻断血流,20mins后,松开动脉夹恢复供血 (即再灌注)。假手术组分离出双侧颈总动脉后进行缝合,其余不作处理。再灌注6h,断头取脑,4%的多聚甲醛固定,脱水,常规石蜡包埋,制成蜡块。
1.2.3 细胞凋亡的形态学观察取制备好的蜡块,连续行5μm厚度的切片,苏木素-伊红 (HE) 染色,每组取两张片子,每张随机选取海马区5个视野,光镜下计数凋亡细胞数。
1.2.4 免疫组织化学法 (SABC法) 检测Caspase-3的表达取制备好的蜡块,连续行5μm厚度的切片,严格按照免疫组化试剂盒说明书,经脱蜡、水化、抗原修复等步骤操作,直至封片,然后加入一抗 (阴性对照组以PBS代替一抗)、二抗,DAB显色。每组取3张切片,每张切片随机选取3个视野, 于400倍光学显微镜下,观察脑缺血-再灌注6h后Caspase-3的表达情况,计数出现棕黄色颗粒的阳性细胞。
1.3 统计学方法实验数据应用SPSS17.0统计软件处理,以x±s表示,总体差异采用方差分析,并运用SNK-q检验法进行两两比较,P≤0.05差异具有统计学意义。
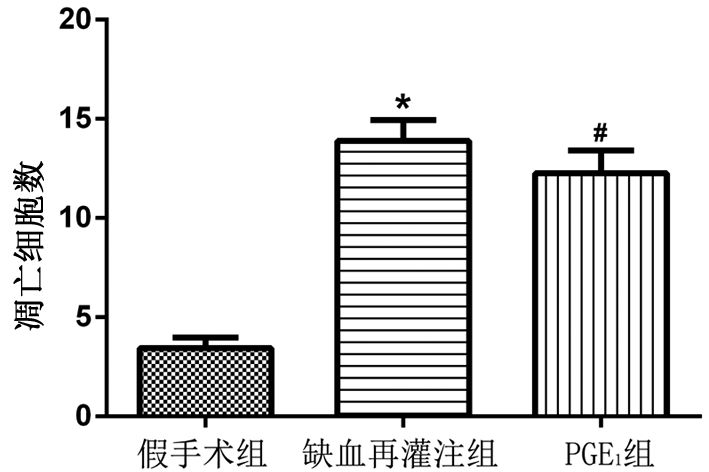
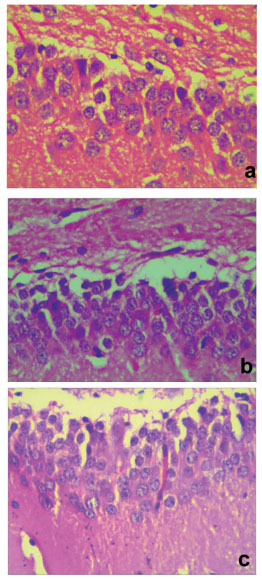
2 结果 2.1 各组缺血-再灌注大鼠脑组织凋亡神经细胞计数假手术组、缺血-再灌模型组及PGE1处理组均可看到凋亡的神经细胞,显示细胞质浓缩,体积缩小,细胞核染色质凝聚成新月状。计数结果显示,与假手术组相比,缺血-再灌注模型组凋亡细胞数明显增加 (P<0.01);PGE1组与模型组相比凋亡细胞数显著减少 (P<0.01)。见图 1、2。
|
图 1 各组缺血-再灌注脑组织凋亡神经细胞数比较 注:3组间比较,F值=67.953,P=0.000;与假手术组相比,* P<0.01;与缺血-再灌注组相比,#P<0.01 |
|
图 2 各组大鼠脑组织 (海马区) 凋亡神经细胞形态学变化 (HE染色,×400) 注:a.假手术组b.缺血再灌模型组c.低剂量组 |
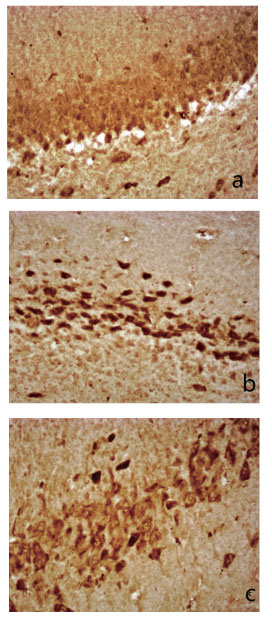
与假手术组比较,模型组大鼠脑组织Caspase-3的表达明显高于假手术组,差异有统计学意义 (q=13.5579,P<0.01),与模型组相比,PGE1组Caspase-3的阳性细胞数显著减少 (q=9.9229, P<0.01)。结果见表 1、图 3。
| 表 1 各组大鼠脑组织Caspase-3阳性细胞数比较 (n, x±s) |
|
图 3 各组大鼠脑组织Caspase-3的表达 (SABC染色,×400) 注:a.假手术组b.缺血-再灌模型组c.低剂量组 |
临床研究报道,用PGE1治疗脑卒中, 病人的神经功能症状,肌力、语言能力恢复等较好, 且治愈后的复发率较低[4-6]。既往实验研究发现,PGE1对多种器官缺血-再灌注损伤具有保护作用。随着分子生物学研究的不断深入,人们发现脑缺血-再灌注可诱发神经细胞凋亡[7], 有报道脑缺血2h再灌注0.5h,可见有较多的凋亡细胞,随着再灌注时间的延长,在多个脑区均有凋亡细胞的分布[8],认为细胞凋亡是脑缺血-再灌注后引起继发性损害的重要原因之一,而细胞凋亡过程又是受多个相关的促凋亡和抑凋亡基因严格控制的级联反应。半胱氨酸天冬氨酸蛋白酶 (Cysteine aspartic acid protease,Caspase) 家族是一大类调控凋亡的重要蛋白酶, 在凋亡过程中发挥始动和效应作用。国内外研究均证实,在缺血-再灌注损伤的脑组织Caspase-3的表达增强,凋亡细胞数增多, 且两者存在相关性。Caspase-3抑制剂可使缺血区脑组织凋亡细胞数明显减少,并进一步证明了Caspase-3是细胞凋亡的重要执行者,在细胞凋亡的级联反应中发挥着关键作用[9-15]。所以,Caspase-3已成为研究防治脑缺血-再灌注损伤药物的靶点。PGE1对脑缺血-再灌注损伤保护作用是否与其抑制神经细胞凋亡有关的研究也较少。鉴于神经细胞凋亡及促凋亡调节基因Caspase-3与脑缺血-再灌注损伤关系密切, 本文利用大鼠全脑缺血-再灌注模型, 旨在探讨PGE1是否通过抑制神经细胞凋亡及促凋亡基因Caspase-3的表达发挥脑保护作用, 从分子水平探讨与之有关的作用机制。
本文结果显示,大鼠全脑缺血20mins再灌注6h后,光镜下发现假手术组海马区偶见散在的凋亡神经细胞,而缺血-再灌注模型组可见大量凋亡的神经细胞,计数结果统计,与假手术组相比有显著性差异 (P<0.01),这一结果又进一步证实了脑缺血-再灌注可诱导神经细胞凋亡;应用PGE1的大鼠脑组织可看到呈凋亡形态学改变的神经细胞明显减少,与模型组相比有显著性差异 (P<0.01),提示PGE1可能通过抑制缺血-再灌脑组织神经细胞凋亡, 发挥脑保护作用的。本文显示在大鼠全脑缺血20mins再灌注6h,Caspase-3在缺血-再灌注组表达显著升高,与假手术组比较有显著性差异 (P<0.05),说明全脑缺血-再灌注后可诱导Caspase-3表达,而PGE1组能使促凋亡基因Caspase-3的表达减少,与缺血-再灌模型组比较有显著性差异 (P<0.05)。多数观点认为,Caspase-3是最关键的凋亡执行蛋白酶,在各种诱因启动的凋亡程序中起最后枢纽作用,所以,抑制其表达可以使凋亡细胞数量减少。目前研究已证明,脑缺血-再灌注后可造成氧自由基 (OFR) 爆发性增加,是诱发神经细胞凋亡的触发因子。本文及其他研究证明,PGE1有较强的抗氧化作用,可抑制自由基的产生,提高抗氧化酶的活性。故推测PGE1减少缺血-再灌注脑组织神经细胞的凋亡,可能与抑制自由基的产生,脂质过氧化减弱,进而抑制Caspase-3等促凋亡基因的激活有关。
| [1] | 周如君, 武英. 前列地尔的剂型及临床研究进展[J]. 中国煤炭工业医学杂志, 2014(11): 1883–1887. DOI:10.11723/mtgyyx1007-9564201411055 |
| [2] | 戴伟娟, 王旭, 张伟, 等. 前列腺素E1对脑缺血再灌注损伤的治疗作用[J]. 济宁医学院学报, 2001, 24(3): 13–14. DOI:10.3969/j.issn.1000-9760.2001.03.006 |
| [3] | 冯国清, 吴红霞, 王振基, 等. 前列腺素E1对脑缺血再灌注损伤的保护作用[J]. 中国药理学通报, 2003, 19(4): 427–431. DOI:10.3321/j.issn:1001-1978.2003.04.017 |
| [4] | 李连, 王建明. 前列腺素E1治疗急性脑梗塞的疗效观察[J]. 脑与神经疾病杂志, 2000, 8(1): 34–35. DOI:10.3969/j.issn.1006-351X.2000.01.011 |
| [5] | 杨红雯, 任会英. 前列腺素E_1治疗急性脑梗塞临床观察[J]. 航空航天医药, 2005(3): 24. |
| [6] | 王淼, 荣阳, 荣根满. 前列腺素E1治疗脑梗死合并冠心病的疗效分析与临床研究[J]. 中国医药指南, 2016, 14(15): 79–80. |
| [7] | Peng J, Mao XO, Stevenson FF, et al. The herbicide paraquat induces dopaminergic nigral apoptosis through sustained activation of the JNK pathway[J]. J Biol Chem, 2004, 279(31): 32626–32632. DOI:10.1074/jbc.M404596200 |
| [8] | Dong C, Yang DD, Tournier C, et al. JNK is required for effector T-cell function but not for T-cell activation[J]. Nature, 2000, 405(6782): 91–94. DOI:10.1038/35011091 |
| [9] | 刘天会, 陈瑞, 杜艳玲. 小鼠短暂前脑缺血海马中半胱天冬酶-3酶原表达的变化[J]. 中国生物化学与分子生物学报, 2006, 22(1): 55–58. DOI:10.3969/j.issn.1007-7626.2006.01.009 |
| [10] | Chen J, Nagayama T, Jin K, et al. Induction of caspase-3-like protease may mediate delayed neuronal death in the hippocampus after transient cerebral ischemia[J]. J Neurosci, 1998, 18(13): 4914–4928. |
| [11] | Ferrer I, Friguls B, Dalfó E, et al. Caspase-dependent and caspase-independent signalling of apoptosis in the penumbra following middle cerebral artery occlusion in the adult rat[J]. Neuropathol Appl Neurobiol, 2003, 29(5): 472–481. DOI:10.1046/j.1365-2990.2003.00485.x |
| [12] | Zhou HP, Wang MS, Shi F, et al. Effects of acupuncture pre-conditioning on apoptosis in hippocampal neurons following ischemia-reperfusion injury in aged rats[J]. Zhonghua Yi Xue Za Zhi, 2011, 91(17): 1203–1206. |
| [13] | 王向慧, 王迪. 尼莫地平对大鼠急性脑缺血再灌注损伤NF-κB和caspase-3蛋白表达的影响[J]. 中国生化药物杂志, 2015, 36(1): 10–13. |
| [14] | 王宇卉, 卞杰勇, 强华, 等. 半胱氨酸蛋白酶抑制剂对大鼠脑缺血模型DNA损伤的实验研究[J]. 中国临床康复, 2003, 7(7): 1064–1065. DOI:10.3321/j.issn:1673-8225.2003.07.015 |
| [15] | Harrison DC, Davis RP, Bond BC, et al. Caspase mRNA expression in a rat model of focal cerebral ischemia[J]. Brain Res Mol Brain Res, 2001, 89(1-2): 133–146. DOI:10.1016/s0169-328x(01)00058-4 |

