2. 卫生部细胞移植重点实验室临床中心, 青岛 266000;
3. 济宁医学院, 济宁 272029
2. Key Laboratory of Cell Transplantation, Ministry of Health, Qingdao, 266000, China;
3. Jining Medical University, Jining 272029, China
Ⅰ型糖尿病的治疗一直是医疗卫生组织的难题。目前主要用胰岛素注射治疗进行血糖控制,这给患者和社会带来沉重的负担。近几年科学家提出胰岛细胞移植是一种比较可靠的根治糖尿病的方法。而用于移植的胰岛细胞极其匮乏使得这项研究受到限制。人脐带间充质干细胞 (human umbilical cord derived mesenchymal stem cells, HUMSCs) 具有多向分化的潜能,本实验先分离新生儿脐带HUMSCs并鉴定,而后先加入含EGF、β-巯基乙醇的DMEM /F12培养基再加入高糖培养基诱导其向胰岛细胞分化,希望通过本实验建立稳定的HUMSCs体外培养体系,提供HUMSCs向胰岛样细胞分化的方法,为临床细胞移植治疗糖尿病提供胰岛细胞来源。
1 材料与方法 1.1 实验材料取足月妊娠行剖宫产手术健康新生儿的脐带8条,每条约取20cm。
DMEM/F12(美国Hyclone公司);胎牛血清 (杭州四季青公司);bFGF (美国Sigma公司);EGF (美国Sigma公司);β-巯基乙醇 (上海试剂四厂)。高糖DMEM (H-DMEM) 培养基 (美国Hyclone公司);β-巯基乙醇 (上海试剂四厂);双硫腙 (美国Sigma公司);DMSO (美国Sigma公司)。
1.2 方法 1.2.1 HUMSCs的分离和传代无菌环境下取正常足月剖宫产娩出的健康新生儿的脐带约20cm, 用0.01mmol/L PBS缓冲液充分冲洗,然后剥离脐带外侧的羊膜及其内侧的脐动、静脉,取剩余组织,用眼科剪将组织剪成1mm的小块,加入2.5 g/L的胰酶,37 ℃消化30 min,再以终浓度为1.0 g/L Ⅳ型胶原酶37 ℃消化60min。200目铜网过滤,制成单细胞悬液, 1500 rpm离心10min收集细胞,台盼蓝染色行活细胞计数,以5×105个/mL的细胞浓度分装于75 mL培养瓶中。培养基采用DMEM/F12(1:1) 培养基。将培养瓶置于37 ℃、饱和湿度、体积分数5%的CO2培养箱中培养2~3d后,全量换液,丢弃未贴壁细胞,根据细胞生长情况,每3~4天全量换液1次。待细胞生长至70% ~80%融合时,用2.5 g/L的胰蛋白酶消化。消化过程中,用倒置显微镜观察细胞消化情况,待细胞大部分胞体回缩、变圆,即终止消化,然后分为2~3份行传代培养,记为P1代。传代培养每3 d全量换液,在贴壁细胞彼此融合铺满瓶底后,再重复上述操作,传为P2代继续培养,以此类推。每日观察细胞形态,适时拍照。
1.2.2 HUMSCs的鉴定取培养P2代的贴壁细胞加入胰蛋白酶消化后,用含体积分数为1%小牛血清白蛋白PBS调整细胞浓度至1×104/μL。分别加入FITC标记的下列鼠抗人单克隆抗体:CD29、CD73、CD90、CD105、CD34、CD86、CD45、HLA-DR,直标单抗流式细胞仪检测细胞表面标记物的表达。空白对照组,以PBS代替一抗,加入FITC二抗。
1.2.3 HUMSCs向胰岛样细胞的诱导分化待传至P1代细胞达70%~80%融合时进行诱导。移出原来脐带间充质干细胞培养基,2.5g/L胰蛋白酶消化后收集P2代细胞,实验组用含有10ng/mL EGF及1mmol/Lβ-巯基乙醇的DMEM/F12(不含FBS) 培养基诱导6d,之后吸去旧培养基,PBS洗细胞2次,接着加入含5%FBS的H-DMEM继续诱导, 细胞生长至70%~80%融合时,胰酶消化传代,传代得到的细胞记为P1代,随后继续加入5%FBS的H-DMEM继续诱导并适时传代。在倒置显微镜下观察细胞形态的变化并拍照。另设对照组不加EGF和β-巯基乙醇。培养方法同上。
1.2.4 RT-PCR检测HUMSCs诱导后细胞中Insulin及PDX-1表达情况收集P2,P4,P6代HUMSCs诱导后的细胞,参照Trizol (美国Invitrogen公司) 提取不同代次实验组和对照组细胞各自的总RNA,取1μg RNA合成cDNA PCR鉴定人Insulin及PDX-1表达的方法按照RNA PCR试剂盒 (北京天根生化科技公司) 说明书操作。基因引物的设计用primer 5软件,由Invitrogen公司合成,引物序列表见表 1。
| 表 1 PCR-引物序列 |
取HUMSCs诱导培养后的P2代细胞团和未诱导的对照组细胞,吸除培养基,PBS洗细胞2次后,各加入5ml PBS及50μl双硫腙工作液 (终浓度l%,V/V),放置37 ℃孵育箱中,15min后移出液体,PBS洗细胞2次,倒置显微镜下观察细胞着色情况并拍照。
1.3 统计学方法采用SPSS19.0统计学软件处理数据,各组率的比较采用χ2检验。
2 结果 2.1 HUMSCs形态学观察分离脐带胰蛋白酶等消化后得到的单细胞,行台盼蓝活细胞计数>96%。培养基中,细胞在接种4 h后陆续开始贴壁,2 d后细胞完全贴壁。6~7d后倒置显微镜下细胞像成纤维细胞样呈现长梭形形态,生长均匀,大致平行排列,呈现成纤维样细胞形态。见图 1。

|
图 1 脐带间充质干细胞培养光镜图 (×400) |
取培养P2代贴壁的HUMSCs,加入FITC标记的下列鼠抗人单克隆抗体:CD29、CD73、CD90、CD105、CD34、CD86、CD45、HLA-DR,直标单抗流式细胞仪检测细胞表面标记物的表达。流式细胞仪分析结果显示,从脐带分离培养的细胞高表达CD29、CD73、CD90、CD105,不表达CD86,极低表达CD45、HLA-DR、CD34。见图 2。
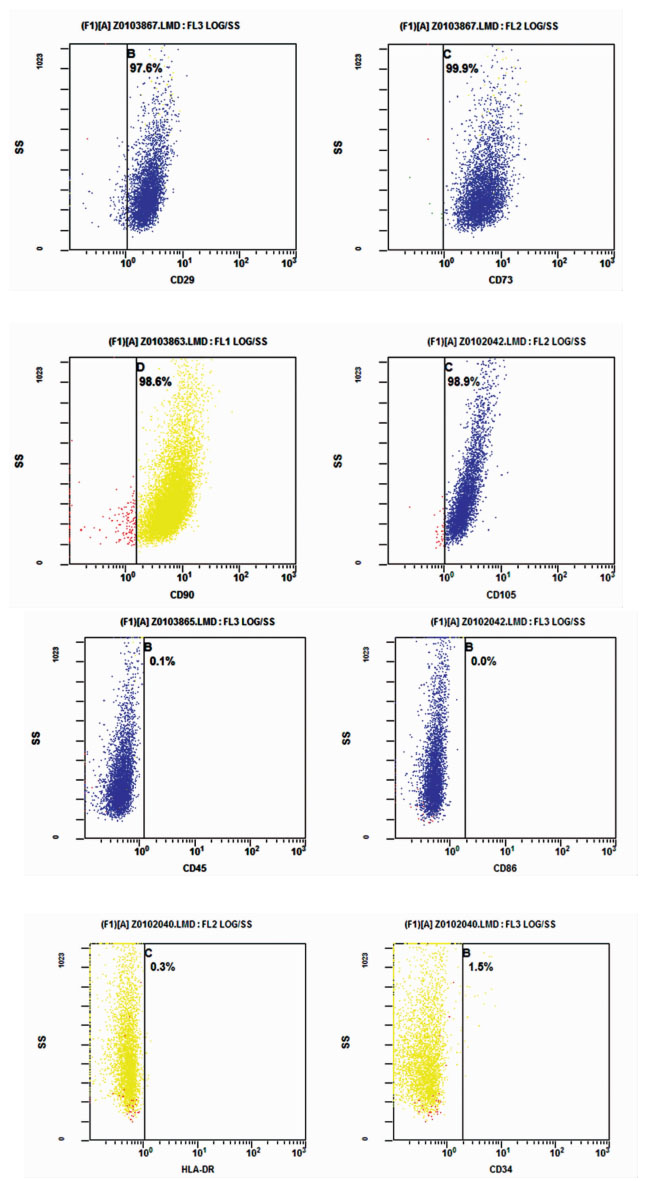
|
图 2 流式细胞仪检测特异细胞标记物的表达 |
先加入含有EGF及β-巯基乙醇的DMEM /F12(不含FBS) 培养基6d,而后加入高糖培养基诱导后,细胞透亮折光较好,形态开始出现变化,由原来的成纤维状逐渐开始转变成类圆形,多角形以及不规则形状,部分细胞逐渐变成细胞团状,而对照组变化不大。见图 3。

|
图 3 HUMSCs的诱导分化 (×400) 注:a.诱导分化12d实验组细胞光镜照片,b.诱导分化12d对照组细胞光镜照片 |
取P2、P4和P6实验组及对照组HUMSCs经EGF、β-巯基乙醇诱导6d后,实验组细胞 (右) 可检测到PDX-1的阳性表达而对照组 (左) 不表达PDX-1;加入高糖培养基继续诱导6d后实验组胰岛素基因Insulin呈阳性表达,而对照组Insulin不表达。见图 4。
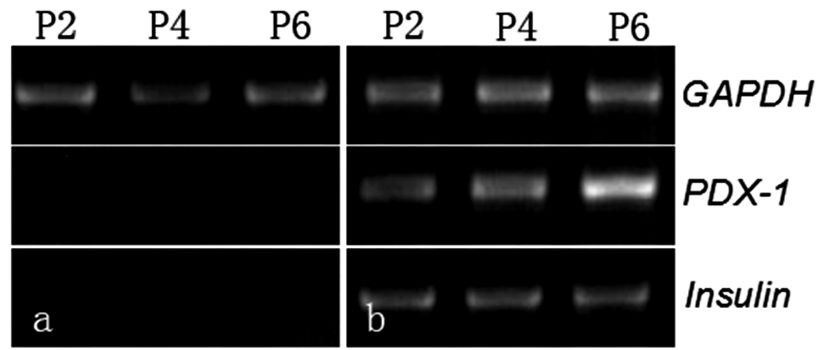
|
图 4 经β-巯基乙醇及高糖诱导后P2,P4,P6代PDX-1及Insulin表达情况 注:a.对照组; b.实验组 |
P2代HUMSCs,经EGF、β-巯基乙醇诱导及高糖培养基继续诱导培养,取诱导后的P2代实验组细胞团和未诱导的对照组细胞,双硫腙染色,鉴别胰岛β细胞内锌离子螯合情况[1]。实验组细胞部分细胞胞浆被染成棕红色,呈双硫腙阳性染色 (图 5-a),提示HUMSCs经EGF、β-巯基乙醇及之后的高糖诱导后的细胞含锌离子,对照组则不染色 (图 5-b)。

|
图 5 HUMSCs诱导分化后双硫腙染色 注:a.实验组 (×400);b.对照组 (×100) |
HUMSCs是指一种存在于新生儿脐带组织中的多功能干细胞,可在体外进行分离、培养,具有稳定的生物性能,可多次传代扩增,并能向许多种组织内的细胞分化。HUMSCs取材方便,易于收集、保存,具有不受道德及法律的限制等优点,是一种很好的干细胞来源。Schugar等研究者采用了组织块法和酶消化法两种方法分别培养出脐带间充质干细胞,这也是目前较为常用的两种方法[2-3]。本实验采用的是改良后的胰酶加Ⅳ型胶原酶消化法,倒置显微镜下观察到细胞贴壁生长,数日后像成纤维细胞样呈现长梭形形态与脐带间充质干细胞形态一致。HUMSCs表达CD29、CD59、CD105、CD44、CD73、CD90等标记物,不表达或低表达造血细胞的细胞标记物CD14、CD33、CD34、CD28、CD45、CD217[4]。本实验用流式细胞术鉴定从脐带分离培养的细胞,高表达脐带间充质干细胞的细胞标记物CD29、CD73、CD90、CD105, 造血细胞标记物CD34、CD45表达极低或不表达。这些标记物的表达都符合HUMSCs的标准,认为本实验从脐带分离的细胞, 用改良后的胰酶加Ⅳ型胶原酶消化法培养也可以得到脐带间充质干细胞。
HUMSCs向胰岛β细胞分化的诱导因素包括两大类:一类为启动胰岛β细胞特异性转录因子的生物因子, 如bFGF、肝细胞生长因子、尼克酰胺等。另一类为诱导nestin蛋白的表达, 如β-巯基乙醇、DMSO等。Nestin属于第6类中间丝蛋白, 主要表达于神经系统发育中的神经干细胞和祖细胞, 可作为神经干细胞和祖细胞的特异性标记物[5-6]。从胚胎发育的位置分析,神经元细胞与胰腺内分泌细胞离得很近,因此有报道尝试先将干细胞诱导分化为神经细胞前体,然后再诱导其向胰岛样细胞分化,取得了很好的效果[7]。马桂霞等[8]报道,在DMEM培养基中先加入β-巯基乙醇、尼克酰胺等先行诱导而后用高糖诱导脐带HUMSCs,获得了胰岛细胞。本实验在DMEM /F12培养基中先加入了bFGF,EGF,β-巯基乙醇培养一段时间,目的是用β-巯基乙醇诱导HUMSCs向神经前体细胞转变,而bFGF作为启动胰岛β细胞的特异性转录因子,促进向胰岛β细胞分化,bFGF也可促使细胞分裂增殖,有利于获得更多的胰岛细胞。在较短时间内,高浓度葡萄糖不仅可以增强胰岛β细胞胰岛素基因的表达,还可以刺激干细胞向胰岛β样细胞分化。因此,本诱导实验中随后加入高糖培养基,诱导HUMSCs向胰岛样细胞分化。结果在倒置显微镜下观察到实验组细胞部分呈球团样生长,与胰岛细胞的形态相似。
近年来研究发现PDX-1是胰腺发育的至关重要的基因,可促进胰腺早期发育和晚期胰岛β细胞的分化,还可促进胰岛素、葡萄糖转运蛋白-2及胰岛淀粉样多肽的转录,甚至与胰岛的再生有关,因此,PDX-1可作为胰腺干细胞的特异性标志之一[9-10]。本实验用RT-PCR检测了第2代,第4代和第6代HUMSCs经bFGF,EGF,β-巯基乙醇诱导后细胞PDX-1的表达,实验组均出现相应的PDX-1蛋白条带,对照组无PDX-1蛋白的表达,加入高糖培养基后检测到的胰岛素的表达也是如此。经双硫腙染色来鉴别细胞内锌离子螯合情况,实验组细胞部分细胞胞浆被染成棕红色,说明此部分细胞内有锌离子螯合情况。综上所述, 在体外含有bFGF,EGF,β-巯基乙醇及后来的高糖培养基的微环境中HUMSCs可诱导出具有胰岛素分泌功能的胰岛细胞。利用本实验方法得到的HUMSCs经诱导分化可以得到胰岛样细胞,但诱导得到的胰岛样细胞若植入体内后,是否能分泌合适的胰岛素等激素水平去发挥正常内分泌细胞的功能,仍需要深入研究。希望能通过努力为糖尿病病人从细胞水平提供一个较好的细胞来源。
| [1] | Shiroi A, Yoshikawa M, Yokota H, et al. Identification of insulin-producing cells derived from embryonic stem cells by zinc-chelating dithizone[J]. Stem Cells, 2002, 20(4): 284–292. DOI:10.1634/stemcells.20-4-284 |
| [2] | Schugar RC, Chirieleison SM, Wescoe KE, et al. High harvest yield, high expansion, and phenotype stability of CD146 mesenchymal stromal cells from whole primitive human umbilical cord tissue[J]. J Biomed Biotechnol, 2009, 2009: 789526. DOI:10.1155/2009/789526 |
| [3] | 高彦琳, 张宁坤, 陈厚良, 等. 改良原代培养体系提高人脐带间充质干细胞的产量[J]. 中国组织工程研究, 2015, 19(10): 1477–1481. DOI:10.3969/j.issn.2095-4344.2015.10.001 |
| [4] | Ma L, Feng XY, Cui BL, et al. Human umbilical cord Wharton's Jelly-derived mesenchymal stem cells differentiation into nerve-like cells[J]. Chin Med J, 2005, 118(23): 1987–1993. |
| [5] | Lumelsky N, Blondel O, Laeng P, et al. Differentiation of embryonic stem cells to insulin-secreting structures similar to pancreatic islets[J]. Science, 2001, 292(5520): 1389–1394. DOI:10.1126/science.1058866 |
| [6] | 袁丽丽, 马登殿, 孔佑华. EPO促进胚胎神经干细胞向神经元分化的形态学研究[J]. 济宁医学院学报, 2014, 37(5): 313–315. DOI:10.3969/j.issn.1000-9760.2014.05.003 |
| [7] | Naujok O, Francini F, Picton S, et al. A new experimental protocol for preferential differentiation of mouse embryonic stem cells into insulin-producing cells[J]. Cell Transplant, 2008, 17(10-11): 1231–1242. DOI:10.3727/096368908787236549 |
| [8] | 马桂霞, 何红燕, 罗敏洁, 等. 人脐带间充质干细胞分化为胰岛β细胞的实验研究[J]. 实用儿科临床杂志, 2008, 23(8): 618–620. DOI:10.3969/j.issn.1003-515X.2008.08.022 |
| [9] | Tang DQ, Cao LZ, Burkhardt BR, et al. In vivo and in vitro characterization of insulin-producing cells obtained from murine bone marrow[J]. Diabetes, 2004, 53(7): 1721–1732. DOI:10.2337/diabetes.53.7.1721 |
| [10] | Cho YM, Lim JM, Yoo DH, et al. Betacellulin and nicotinamide sustain PDX1 expression and induce pancreatic beta-cell differentiation in human embryonic stem cells[J]. Biochem Biophys Res Commun, 2008, 366(1): 129–134. DOI:10.1016/j.bbrc.2007.11.112 |

