2. 济宁医学院附属医院, 济宁 272029;
3. 安康市中心医院, 安康 725000
2. Affiliated Hospital of Jining Medical University, Jining 272029, China;
3. Ankang City Central Hospital, Ankang 725000, China
透明质酸水凝胶 (hyaluronic acid hydrogel, HAH) 是透明质酸与相应交联剂交联,形成具有一定的生物相容性、可降解以及无免疫原性的水凝胶,在再生医学领域广泛应用与研究。HAH在包封细胞时,可以为细胞提供三维立体生长环境,克服了二维环境里的“接触抑制”,同时还具有一定的机械强度,可与细胞相互作用,常被用于组织工程的水凝胶支架[1]。因其在制备过程中,不同浓度的HAH在包封细胞时对细胞形态及增殖活性等方面的作用具有明显差异,特别是当被包封的细胞与HAH包封前经过特殊处理时 (如转染病毒、质粒、mRNA等),如果忽略,最后取得的实验结果甚至可能与预期相反,经常困扰着科研工作者。而且在骨与关节再生研究中,骨髓间充质干细胞 (bone marrow mesenchymal stem cells, BMSCs) 由于易提取、低免疫原性、多向分化潜能等具有良好应用前景[2];骨形态发生蛋白2(bone morphogenetic protein 2,BMP-2) 是唯一经FDA批准用于骨移植替代的生长因子[3]。故我们联合HAH、BMP-2与BMSCs三者构建一种新的组织工程材料,研究其对BMSCs活性的影响。目前,不同浓度HAH对包封未进一步处理的BMSCs的影响已见报道[4],但是关于使用HAH包封对进一步处理的BMSCs研究较少。本文采用不同浓度HAH (2、4、8、12g/L) 包封经携带BMP-2基因的腺病毒载体基因修饰BMSCs (Ad-BMP-2 BMSCs),探讨不同浓度HAH下对Ad-BMP-2 BMSCs细胞三维形态、增殖活性及其表达BMP-2的影响。
1 材料与方法 1.1 材料 1.1.1 实验动物健康新西兰胎兔4只,雌雄不拘,1月龄,体重约0.5kg, 购于山东省鲁抗医药股份有限公司实验动物中心。
1.1.2 试剂器材胎牛血清、DMEM/F12培养基 (美国Gibco公司);戊巴比妥钠 (北京索莱宝公司);小鼠抗兔CD14-APC (德国Miltenyi公司);小鼠抗兔CD31-PE (美国Novus Biologicals公司);小鼠抗兔CD90-PE (德国antibodies-online公司);小鼠抗兔CD105-FITC (美国GeneTex公司);透明质酸水凝胶试剂盒 (美国BioTime公司);CCK-8试剂盒 (日本Dojindo公司);Ad-BMP-2(上海汉恒生物公司);人BMP2酶联免疫试剂盒 (武汉博士德生物公司)。
1.2 方法 1.2.1 BMSCs的提取、培养、鉴定新西兰胎兔经耳缘静脉缓慢推注1%戊巴比妥钠 (3.5 ml /kg),速度约1ml/min。通过呼吸、角膜反射判断麻醉深度。然后取侧卧位,双侧髂前上棘备皮、消毒、铺巾; 经左侧髂前上棘抽取兔骨髓液3~5 ml,依序抽取另一侧。将骨髓液与PBS等比例混合,将稀释的骨髓液轻轻滴加在等量的Percoll分离液上方,水平离心30min (2500r/min), 溶液分4层,吸取乳白色单核细胞层,将提取的细胞用DMEM/F12培养基 (含1%青-链霉素、10%胎牛血清) 重悬,转移至培养瓶 (25cm2),换液,通过选择性消化进行传代,期间通过倒置荧光相差显微镜进行观察BMSCs生长状态。培养至第三代进行成骨、成脂诱导分化,同时另取第三代细胞按照抗体说明书分别加入抗兔CD14、CD31、CD90、CD105抗体进行流式细胞检测;另取同批细胞分别进行同型对照。
1.2.2 最佳感染复数 (multiplicity of infection, MOI) 值的确定取第三代BMSCs,细胞计数后,转移至六孔板 (106/孔),12h后换液,每孔加入1/2体积的培养基,然后按照MOI值分别为50、80、100、120、200的Ad-BMP-2加入到六孔板中,每种MOI值设3个复孔,4~6h后换液,24h后上流式细胞仪检测感染效率以及细胞生存率,确定最佳MOI值。
1.2.3 不同浓度HAH的制备及包封HAH试剂盒包括经巯基修饰的透明质酸 (HyStemTM)、聚乙二醇二丙烯酸酯 (ExtralinkTM) 和脱气去离子水3个组分;将脱气去离子水按照试剂盒说明书加入HyStemTM、ExtralinkTM中,分别配成2、4、8、12g/L的HAH;然后分别将提前准备好的Ad-BMP-2 BMSCs使用水凝胶进行重悬。
1.2.4 不同浓度下Ad-BMP-2 BMSCs细胞三维形态观察将上面制备的不同浓度的HAH与Ad-BMP-2 BMSCs重悬后,移植到预先经多聚赖氨酸包埋的盖玻片上,待HAH凝固后加入细胞培养基培养,24h后将构建好的材料用4%多聚甲醛进行固定,PBS洗涤干燥后,树胶封片,置于激光共聚焦显微镜下对细胞形态进行观察。
1.2.5 细胞增殖活性检测将用不同浓度HAH包封Ad-BMP-2 BMSCs后的混合物,在凝胶之前分别加入8块96孔板中 (100μl/孔),每种浓度HAH设3个复孔;对照组为没有包封HAH的Ad-BMP-2 BMSCs,同时对于每种浓度的HAH分别设置没有包封Ad-BMP-2 BMSCs的作为阴性对照,每孔加入200μl培养基后放入CO2恒温细胞培养箱培养。分别于第1、2、4、6、8、10、12、14天不同时间点根据CCK-8说明书检测Ad-BMP-2 BMSCs的增殖活性。
1.2.6 ELISA检测BMP-2的表达借助于上一步,在每个时间点检测CCK-8法前,将细胞上清液收集至EP管中,-20℃保存,待14d收集完细胞上清液后,根据ELISA试剂盒的说明书对细胞上清液中的BMP-2的表达进行检测。
1.3 统计学方法数据采用SPSS 19.0统计软件进行统计学处理,数据使用x±s表示,组间比较采用单因素方差分析,方差齐性检验后组间两两比较用LSD-t检验,以P<0.05为差异有统计学意义。
2 结果 2.1 BMSCs的培养及鉴定倒置显微镜下观察原代单个细胞形态呈典型梭形,生长至80%~90%融合时呈旋风样分布。培养至第三代,诱导分化为成骨细胞、脂肪细胞。流式细胞仪细胞表面分子标志结果显示:BMSCs低表达CD31、CD14, 高表达CD90、CD105。细胞形态、分化特性、细胞表面分子标志结果均符合BMSCs特性。见图 1。

|
图 1 BMSCs的培养及鉴定 注:A为原代BMSCs (×50);B为BMSCs定向诱导为成骨细胞 (茜素红染色,×200);C为BMSCs定向诱导为脂肪细胞 (油红染色,×200);D为Ad-BMP-2最佳感染复数 (MOI) |
以不同的MOI值的Ad-BMP-2转染BMSCs,24h后流式细胞仪检测细胞表达绿色荧光蛋白 (green fluorescent protein,GFP) 所占的比例作为转染效率,结果显示MOI值为50、80、100、120、200时,转染率分别为69.68%、70.87%、75.21%、85.69%、85.21%;细胞生存率分别为98.87%、97.43%、95.24%、75.85%、55.23%。当MOI值超过100时,转染率增加不明显,但BMSCs生存率明显下降,故BMSCs最佳MOI值为100(图 1D)。
2.3 不同浓度HAH包封下的Ad-BMP-2 BMSCs细胞三维形态激光共聚焦显微镜下三维重建可见Ad-BMP-2 BMSCs在不同浓度HAH中呈现不同的形态;Ad-BMP-2 BMSC在0g/L HAH包封下呈长梭形,2g/L、4g/L和8g/L HAH包封下向多个方向铺展,具有充足生长空间、在12g/L HAH包封下呈类圆形。见图 2。
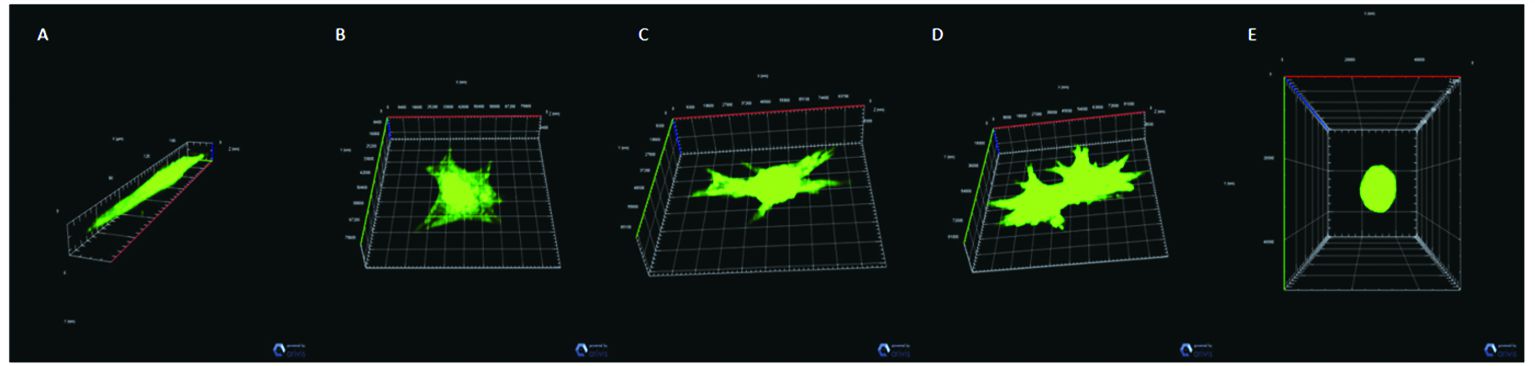
|
图 2 激光共聚焦显微镜三维重建不同浓度HAH包封下的Ad-BMP-2 BMSCs形态 注:A-E分别为不同浓度HAH (0、2、4、8、12g/l) 包封下Ad-BMP-2 BMSCs形态 (×200) |
CCK-8法结果显示1~3d为生长稳定期,从第4天后进入对数生长期,之后由于生存环境差异,分别于第6天、第8天后进入平台期。将多个组的增殖能力进行比较,差异均有统计学意义 (P<0.05);随将8g/L组与0g/L组、2g/L组、12g/L组相比,增殖能力均有差异 (P<0.05),但与4g/L组相比差异无统计学意义 (P>0.05);8g/L组的增殖能力最优,明显优于其他各组,且对数生长期持续时间最长。见图 3。
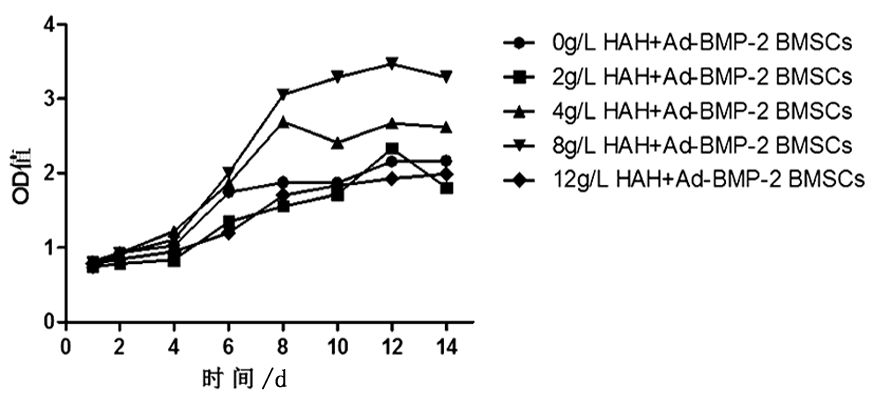
|
图 3 不同浓度HAH包封下的Ad-BMP-2 BMSCs细胞增殖活性 |
ELISA检测细胞上清液BMP-2的表达,结果显示各组均可正常表达BMP-2,各组间比较差异具有统计学意义 (P<0.05),4 g/L组与8 g/L组BMP-2的表达略高于0 g/L组、2 g/L组和12 g/L组,其中2 g/L组BMP-2表达量最低,考虑与HAH浓度太低,BMSCs不能有效黏附在材料中生长,大多数BMSCs仍贴壁生长于96孔板底部有关。见图 4。

|
图 4 不同浓度HAH包封下BMP-2的分泌量 注:与8g/LHAH+Ad-BMP-2 BMSCs组相比,*P<0.05 |
透明质酸是组织细胞外基质的主要成分之一,由于其固有的生物相容性、可降解性、无免疫原性、可协助机体保持水分及润滑关节等特性,在再生医学领域得到广泛应用。由于透明质酸构建的水凝胶支架又常被用做细胞生长和组织修复的良好媒介,在组织工程被公认为是一种理想生物材料[1]。
HAH主要成分是透明质酸,不同性质的透明质酸对细胞的作用差异很大。高分子量的透明质酸具有抗炎[5]、抗血管形成的作用[6];而低分子量的透明质酸具有促进炎症反应、促进血管生成的作用[7]。在其构成的HAH上,主要研究的是不同浓度的HAH包封携带BMP-2腺病毒载体转染兔BMSCs后对细胞形态及增殖能力的影响。BMP-2属于转化生长因子超家族,在美国已被批准应用于临床[3],具有刺激骨再生,影响骨代谢。BMP-2具有诱导BMSCs分化为软骨细胞、成骨细胞,引起众多学者的兴趣。但BMP-2是由26kb大小的两个相同单体构成的二聚体蛋白多糖,直接注入体内或局部应用存在半衰期短、弥散障碍等缺陷,限制了其广泛应用。为此,研究者在这方面进行了多种探索,Liu等[8]在研究BMP-2刺激BMSCs分化及成骨时发现,BMP-2可被结合到多聚物支架上,并允许可控释放,但支架材料结合BMP-2的量有限。Xu等[9]将BMP-2结合到透明质酸水凝胶纳米粒子上也可实现可控释放,但同样克服不了纳米粒子结合有限BMP-2的问题。近年来,随着基因工程、组织工程的发展,将目的基因通过载体转染到种子细胞中短期或永久表达,联合细胞支架,构建出一种新的组织工程材料,应用于再生医学研究领域中已成为一种趋势。BMSCs来源于骨髓间质,具有取材方便、体外生长迅速、多向分化潜能等优点,使其在组织工程构建中成为一种非常有前景的种子细胞。另外作者已通过基因修饰使BMP-2在BMSCs中表达[10],在此基础上,我们将Ad-BMP-2包封于不同浓度的HAH中,研究HAH对细胞形态、增殖能力以及BMP-2表达的影响。
本实验中,体外提取兔BMSCs,培养、鉴定以及转染提前构建好的携带BMP-2的腺病毒载体,并构建了4种不同浓度的HAH,包封携带BMP-2腺病毒载体转染兔BMSCs。在细胞形态上,通过激光共聚焦三维重建我们发现在2、4、8g/L HAH包封下可向多个方向铺展,有充足生长空间,在12g/L HAH包封下呈圆形。说明不同浓度的HAH,为细胞提供的网孔大小不同,BMSCs呈现不同的形态特征。细胞增殖活性在不同浓度的HAH包封下,8g/L的HAH增殖能力最好,明显优于其他各组,且对数生长期持续时间最长 (P<0.05)。另外在8g/LHAH包封下的BMP-2表达量优于其他各组 (P<0.05)。
综上所述,在不同浓度HAH包封下携带BMP-2腺病毒载体转染兔BMSCs后,在8g/L的HAH包封下Ad-BMP-2 BMSCs在材料中可充分铺展、细胞增殖活性最好并可表达目的蛋白。但本实验未对HAH的浓度进行更详细的构建以及未对不同浓度HAH包封携带BMP-2腺病毒载体转染兔BMSCs后进行较长时间 (如20、30d) 的研究评估。因此,在HAH包封下关于经过基因修饰的BMSCs细胞形态、增殖活性及目的蛋白表达方面还有待进一步研究。
| [1] | Lei Y, Gojgini S, Lam J, et al. The spreading, migration and proliferation of mouse mesenchymal stem cells cultured inside hyaluronic acid hydrogels[J]. Biomaterials, 2011, 32(1): 39–47. DOI:10.1016/j.biomaterials.2010.08.103 |
| [2] | Huang YC, Leung VY, Lu WW, et al. The effects of microenvironment in mesenchymal stem cell-based regeneration of intervertebral disc[J]. Spine J, 2013, 13(3): 352–362. DOI:10.1016/j.spinee.2012.12.005 |
| [3] | Belykh E, Giers M, Bardonova L, et al. The role of bone morphogenetic proteins 2, 7, and 14 in approaches for intervertebral disk restoration[J]. World Neurosurg, 2015, 84(4): 871–873. DOI:10.1016/j.wneu.2015.08.011 |
| [4] | 李凯, 吕少一, 周建业, 等. 不同浓度透明质酸水凝胶的细胞相容性[J]. 中国组织工程研究, 2013, 17(16): 2927–2934. DOI:10.3969/j.issn.2095-4344.2013.16.011 |
| [5] | Day AJ, de la Motte CA. Hyaluronan cross-linking:a protective mechanism in inflammation[J]. Trends Immunol, 2005, 26(12): 637–643. DOI:10.1016/j.it.2005.09.009 |
| [6] | West DC, Kumar S. Hyaluronan and angiogenesis[J]. Ciba Found Symp, 1989, 143: 187–201. DOI:10.1002/9780470513774.ch12 |
| [7] | West DC, Hampson IN, Arnold F, et al. Angiogenesis induced by degradation products of hyaluronic acid[J]. Science, 1985, 228(4705): 1324–1326. DOI:10.1126/science.2408340 |
| [8] | Liu HW, Chen CH, Tsai CL, et al. Heterobifunctional poly (ethylene glycol)-tethered bone morphogenetic protein-2-stimulated bone marrow mesenchymal stromal cell differentiation and osteogenesis[J]. Tissue Eng, 2007, 13(5): 1113–1124. DOI:10.1089/ten.2006.0209 |
| [9] | Xu X, Jha AK, Duncan RL, et al. Heparin-decorated, hyaluronic acid-based hydrogel particles for the controlled release of bone morphogenetic protein 2[J]. Acta Biomater, 2011, 7(8): 3050–3059. DOI:10.1016/j.actbio.2011.04.018 |
| [10] | Zhang C, Liu HM, Li QW, et al. Construction of recombinant adenovirus vector containing hBMP2 and hVEGF165 genes and its expression in rabbit Bone marrow mesenchymal stem cells[J]. Tissue Cell, 2014, 46(5): 311–317. DOI:10.1016/j.tice.2014.06.001 |



