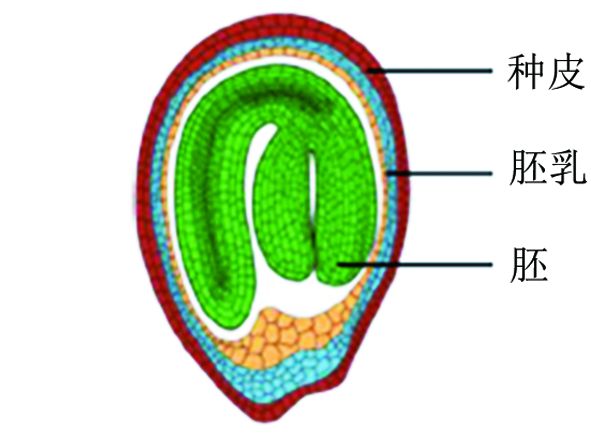
种子是被子植物生命周期的一个重要过程。种子含有植物的基本结构。优异的种子能够为植物生长提供足够的营养、提高活力,因此在种苗时具有更强的抵抗外界不良环境的能力。另外,种子大小也是重要的产量性状[1-2]。高等植物种子发育是一个复杂的生理过程,包括二倍体胚、三倍体胚乳和外周母体组织的发育[3-4]。种子是由胚、胚乳和种皮3部分组成 (图 1)。这3部分的发育过程最终影响着种子大小。在过去几十年,人们就开始大量分析和利用种子大小进行育种,但对决定种子大小的具体分子机理尚不清楚。直到近年来,研究人员才陆续鉴定出调控种子大小的一些基因,这些基因的表达会影响外周母本组织以及胚和胚乳的发育[5-8]。
|
图 1 种子解剖学结构示意图 |
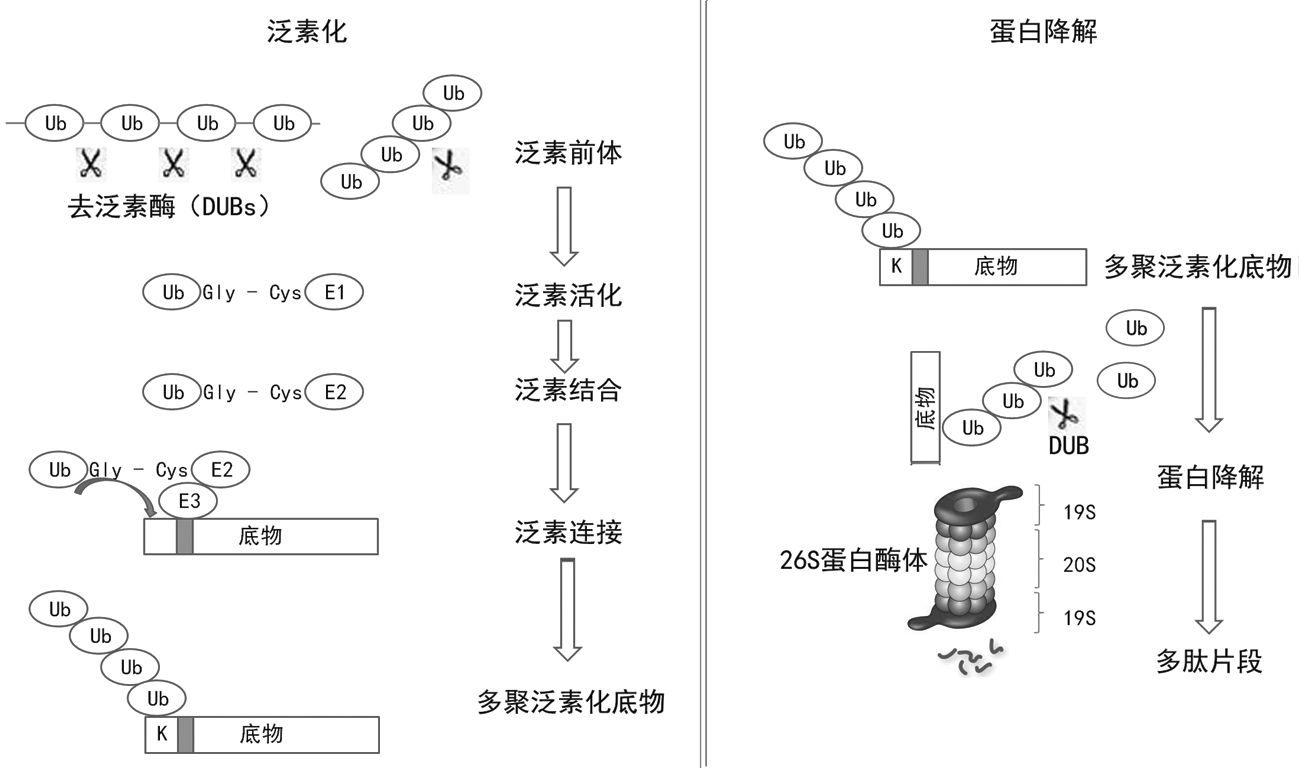
最近的研究发现,泛素/26S蛋白酶系统 (UPS) 在种子大小决定中起重要作用[6-7, 9-10]。该系统主要由泛素、泛素活化酶 (E1)、泛素结合酶 (E2)、泛素连接酶 (E3) 和26S蛋白酶体组成。UPS是植物中最重要的蛋白质降解途径之一,可以特异性地降解无功能多肽,参与信号转导、细胞周期和逆境胁迫响应等多种生理过程[11-13]。
泛素是一个高度保守的小分子球状蛋白。在UPS中,它作为一个标记蛋白,在E1、E2、E3三种酶的级联作用下以共价键的方式连接到靶蛋白上[14]。在这个过程中底物的特异性是由E3决定的 (图 2)。单个泛素与底物蛋白结合可以改变其活性[15];而多次泛素化会形成多聚泛素链,根据结合的泛素的数量和位置决定了靶蛋白的命运。
|
图 2 泛素/26S蛋白酶体途径 泛素化过程:首先,E1利用ATP水解释放的能量活化Ub,然后转移到E2上,最后在有E3或没有E3协助下将Ub连接到靶蛋白上。连有多聚泛肽链的蛋白质结合物一旦形成,或者以依赖ATP的方式被26S蛋白酶体识别并降解掉,或者在去泛素酶 (α-氨基水解酶,DUBs的一种) 的作用下拆散结合物,释放Ub和完整的靶蛋白。蛋白降解:26S蛋白酶体降解泛肽化靶蛋白时的结构和过程。 |
26S蛋白酶体是由两类亚基复合体19S调控颗粒 (RP) 和20S核心颗粒 (CP) 构成的。RP能够识别泛素化底物,去掉泛素,将靶蛋白去折叠,最终运至CP的中心室。CP是蛋白酶体的主要部分,蛋白质在这里发生水解并被降解为多肽段[16]。在UPS过程中,与底物连接的泛素链可以被去泛素化酶 (DUBs) 切除并用于再循环[17]。
近些年的研究发现,泛素途径的多个组分参与种子大小的调控,如泛素受体、E3泛素连接酶、蛋白酶体等。本文就目前关于泛素介导的种子大小调控方面的研究结果及探讨泛素途径在种子发育中的作用作一综述。
1 泛素途径与种子大小调控 1.1 泛素受体DA1和DAR1Li等通过遗传突变从拟南芥中筛选出一个大种子的突变体,命名为da1-1(汉字“大”的意思)[18]。与野生型Col-0相比,da1-1具有更大的的种子。此外,da1-1还有更大的花器官、叶片、长角果等。研究发现da1-1突变是DA1蛋白第358位点的精氨酸突变为赖氨酸 (DA1R358K) 所致。DA1编码一个泛素受体蛋白,能够抑制种子表皮细胞分裂。在拟南芥中有7个与DA1具有较高氨基酸相似性的DA1相关蛋白 (DAR),在其他植物中也有发现DA1同源蛋白。有趣的是,对DA1或与之距离较近的DAR1家族成员分别进行T-DNA插入突变,种子和器官大小不会发生明显的改变;如果同时突变则有明显增大的现象。表明DA1和DAR1对种子和器官大小调控是冗余的。
DA1包含两个泛素互作基序 (UIM) 和一个锌指结合LIM结构 (含有保守的Lin-11、Isl-1和Mec-3结构域)。含UIM基序的蛋白通常具有泛素结合和泛素化位点,可发生单泛素化。而单泛素化又会促进受体构象发生改变,进而调控受体活性或与其他蛋白的结合能力,并启动级联信号途径[19]。DA1可能不仅参与UPS信号途径中泛素结合和泛素化过程, 还能够与多聚泛素化蛋白结合,参与其被26S蛋白酶体降解的过程[11]。此时DA1可能通过UIM结构与多聚泛素化底物相互作用并促进自身降解。DA1这种表达变化会影响种子表皮进而影响到种子的大小。
1.2 E3 RING型E3泛素基因家族EOD1、DA2和GW2拟南芥中有1400多种E3[18]。在UPS中,E3s参与泛素化级联过程的最后一步并特异识别底物蛋白。根据所含保守结构域的不同,植物中的E3s主要有HECT型、RING型和U-box型等[14]。目前已发现有几种RING型E3泛素连接酶对双子叶植物和单子叶植物的种子大小起到关键的调控作用。
Li等分离出一系列da1-1的增强子,并命名为EOD,可以与DA1协同调控植物种子和器官大小[9]。据报道,DA2基因也参与调控种子大小。EOD1和DA2都属于RING型E3泛素连接酶[9, 18]。eod1和da2-1突变体有着相似的表型,都比Col-0具有更大的种子和器官;过量表达EOD1或DA2会产生小的种子和器官[9]。它们都对拟南芥种子大小起负调节作用。eod1和da2-1突变能够协同增强da1-1突变体的表型,说明EOD1和DA2都可以与DA1作用,通过调节下游蛋白活性进而调控种子大小。然而,遗传学分析显示EOD1和DA2对种子大小的调控是独立的[9],二者可能通过DA1靶向降解不同的生长刺激物起作用。EOD1和DA2的协同作用可能是由于它们对同一个蛋白复合物的两个组分进行同时破坏产生的[20]。由此建立了泛素相关蛋白DA1、DA2和EOD1调控种子大小的遗传机制。
在水稻 (Oryza sativa) 中,数量性状基因座GW2编码一个RING型E3泛素连接酶,能够特异识别底物并将其锚定到蛋白酶体进行降解,从而对细胞分裂进行负调节作用[21]。WY3是GW2的一个等位基因,它编码一个比GW2少310个氨基酸的蛋白。片段的缺失使WY3不能特异识别本应降解的底物,但是激活了颖花外壳细胞的增殖,颖花外壳变宽;同时还间接提高了灌浆速率,最终使得颖壳变宽、粒重和产量都有提高。而过表达GW2的转基因水稻与野生型植株相比具有更小、更轻的谷粒。有趣的是,GW2与拟南芥DA2和DA2类蛋白相似性很高[9]。在拟南芥中过表达OsGW2会使种子和器官变小,这种现象在35S:DA2和35S:DAL2转基因植物中也都有观察到[9],说明这类蛋白在拟南芥和水稻中的功能是保守的。GW2的RING结构为C5HC2[22],在玉米、小麦、酵母和真菌中的GW2同源蛋白的RING结构也都属于这种类型。DA2的RING结构域中的Cys残基的间距与GW2的相似[9]。遗传分析以及DA2的E3连接酶活性和其对种子大小的调控作用等这些结果都表明DA2的RING结构域可能是GW2的一种变异。
1.3 泛素特异性蛋白酶UBP15SOD2是DA1的一个抑制基因,它的编码蛋白UBP15是一种去泛素化酶[10],因为含有一个去泛素化必需的泛素特异蛋白酶结构域 (UBP) 而命名。ubp1是da1-1的抑制子。与Col-0相比,UBP15突变体具有更小的叶片、花和种子,而过表达UBP15植株具有更大的种子和器官,表明UBP15是种子和器官生长的正调节子。UBP15通过促进胚珠和种子的细胞分裂来调控种子大小。遗传分析显示在种子大小调控方面,UBP15是da1-1的上位基因,也就是说UBP15可作用于DA1的下游来促进种子生长。加入蛋白酶体抑制剂MG132时,UBP15蛋白较为稳定,说明UBP15能够被26S蛋白酶体降解。此外,DA1通过与UBP15相互作用来调节其稳定性。可能的机制是泛素受体DA1对UBP15进行靶标记并介导其被蛋白酶体降解。然而,UBP15对种子大小的调控作用与EOD1和DA2是相互独立的,即UBP15不是DA2或EOD1的底物蛋白,同时也表明还存有其他E3连接酶参与蛋白酶体对UBP15的降解。
1.4 26S蛋白酶体RP成分RPT2a26S蛋白酶体的RP由含有非ATP酶亚基 (RPN3,5-9,11-12) 的盖子和由6种相关的AAA-ATP酶 (RPT1-6) 以及3种非ATP酶亚基 (RPN1,2和10) 组成的基底构成[23]。Kurepa等发现基底的调节粒子RPT2会影响种子大小。在拟南芥中有两个RPT2的同源蛋白 (RPT2a和RPT2b),它们的氨基酸序列相似性为98.8%。RPT2a的功能缺失会降低26S蛋白酶体的活性,并导致植株多数器官包括种子变大[24]。与Col-0相比,RPT2a突变体的细胞变大,但是其细胞数目减少,表明在细胞数目和细胞大小之间可能存在补偿机制。RPT2a对种子大小的调控机制可能是:RP能够识别细胞生长的正调控子并将其去折叠后运送至CP进行降解,进而影响种子大小。
1.5 APC型E3泛素连接酶调节子SAMBA植物器官的生长是由细胞分裂和细胞生长共同决定的。而细胞周期进程由细胞周期调节子调控,例如细胞周期蛋白[21]。在植物中,A型和B型的细胞周期蛋白会被多亚基E3泛素连接酶APC/C特异识别并被26S蛋白酶体降解,随后细胞进入分裂期。APC/C的活性受激活蛋白或抑制蛋白的调节,如CDC20、CDH1/CCS52、UVI4、UV14/OSD1/GIG1和SAMBA。其中,SAMBA是一种植物特异的APC/C调节子,对种子大小调控起重要作用[25]。在拟南芥中,SAMBA在发育中的种子和早期植物发育阶段中表达。SAMBA的功能缺失会使细胞周期蛋白CYCA2;3较为稳定,促进细胞分裂和核内复制,最终产生大的种子和器官。酵母双杂交实验显示SAMBA与细胞周期蛋白A特异性作用。这些结果表明SAMBA对细胞周期蛋白A靶标记,并介导其被APC/C介导的UPS降解,对种子生长起到负调节子的作用。
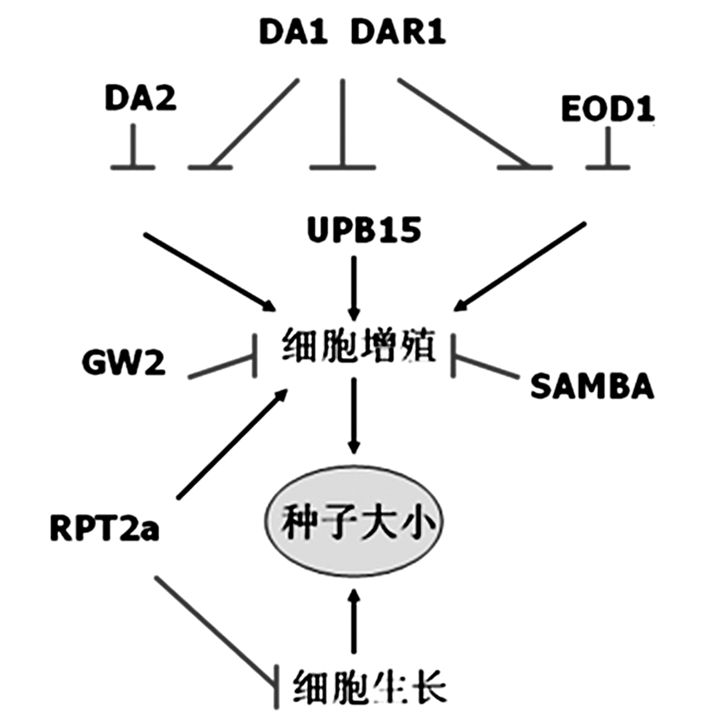
2 展望近年来, 人们陆续发现了一些种子大小调控相关的基因, 其中包括UPS的许多组分[26-30]。有趣的是,大多数基因不仅影响种子大小,还会影响植物器官的生长。例如,da1突变体具有大的种子、叶片和花的表型[18],而sod2突变体则具有较小的种子和器官[10],表明种子和器官大小之间可能存在关联。与此同时,还存在着一些突变体具有大的器官但是其种子是正常大小,说明种子和植物器官的大小也不总是正相关的。越来越多的结果表明不同物种对种子大小的调控既有相似的途径也存在着差异。例如,拟南芥DA2及其在作物中的同源蛋白GW2、TaGW2和ZmGW2都是种子大小的关键调节因子[31-34]。关于泛素介导的种子大小的调控机制,目前我们还未系统地了解,仅发现了一些不完整的、看起来比较独立的通路。见图 3。
|
图 3 泛素途径介导的调控种子大小的分子机制框架图 DA1和DAR1对细胞分裂的抑制作用是冗余的。DA1和DA2通过抑制共同底物来控制细胞增殖。类似地,DA1和EOD1通过另外的共同底物调节细胞分裂。DA1作用于UBP15的上游并调控其稳定性以控制细胞增殖。GW2和SAMBA都是通过限制细胞增殖来控制种子大小。RPT2a通过限制细胞生长来调节种子大小 |
未来的主要挑战是研究种子大小调控中已知基因的功能。例如,一些泛素受体与E3泛素连接酶的特异的靶蛋白是什么,它们又是如何调控的?通过生物化学和遗传方法等鉴定出互作蛋白和下游靶标,填补调控途径中的空白,进而了解这些因子在种子大小控制中的分子机制。另外,利用现代生物技术 (例如全基因组关联研究、基因组编辑、蛋白质组学、代谢组学等) 鉴定出新的参与种子大小调控的基因,进一步阐明决定植物种子大小的分子机制,进而为作物高产育种提供理论基础。
| [1] | Shomura A, Izawa T, Ebana K, et al. Deletion in a gene associated with grain size increased yields during rice domestication[J]. Nat Genet, 2008, 40(8): 1023–1028. DOI:10.1038/ng.169 |
| [2] | Williams K, Sorrells ME. Three-Dimensional Seed Size and Shape QTL in Hexaploid Wheat (Triticum aestivum L.) Populations[J]. Crop Science, 2014, 54(1): 98. DOI:10.2135/cropsci2012.10.0609 |
| [3] | Chaudhury AM, Berger F. Maternal control of seed development[J]. Semin Cell Dev Biol, 2001, 12(5): 381–386. DOI:10.1006/scdb.2001.0267 |
| [4] | Lafon-Placette C, Khler C. Embryo and endosperm, partners in seed development[J]. Curr Opin Plant Biol, 2014, 17: 64–69. DOI:10.1016/j.pbi.2013.11.008 |
| [5] | Kesavan M, Song JT, Seo HS. Seed size:a priority trait in cereal crops[J]. Physiol Plant, 2013, 147(2): 113–120. DOI:10.1111/j.1399-3054.2012.01664.x |
| [6] | Li N, Li Y. Ubiquitin-mediated control of seed size in plants[J]. Frontiers in Plant Science, 2014, 5. DOI:10.3389/fpls.2014.00332 |
| [7] | Li N, Li Y. Signaling pathways of seed size control in plants[J]. Curr Opin Plant Biol, 2016, 33: 23–32. DOI:10.1016/j.pbi.2016.05.008 |
| [8] | Wang Q, Xue X, Li Y, et al. A maize ADP-ribosylation factor ZmArf2 increases organ and seed size by promoting cell expansion in Arabidopsis[J]. Physiol Plant, 2016, 156(1): 97–107. DOI:10.1111/ppl.12359 |
| [9] | Xia T, Li N, Dumenil J, et al. The ubiquitin receptor DA1 interacts with the E3 ubiquitin ligase DA2 to regulate seed and organ size in Arabidopsis[J]. Plant Cell, 2013, 25(9): 3347–3359. DOI:10.1105/tpc.113.115063 |
| [10] | Du L, Li N, Chen L, et al. The ubiquitin receptor DA1 regulates seed and organ size by modulating the stability of the ubiquitin-specific protease UBP15/SOD2 in Arabidopsis[J]. Plant Cell, 2014, 26(2): 665–677. DOI:10.1105/tpc.114.122663 |
| [11] | Stone S L. The role of ubiquitin and the 26S proteasome in plant abiotic stress signaling[J]. Frontiers in Plant Science, 2014, 5. DOI:10.3389/fpls.2014.00135 |
| [12] | Dametto A, Buffon G, Dos Reis Blasié A, et al. Ubiquitination pathway as a target to develop abiotic stress tolerance in rice[J]. Plant Signal Behav, 2015, 10(9). DOI:10.1080/15592324.2015.1057369 |
| [13] | Yu F, Wu Y, Xie Q. Ubiquitin-Proteasome System in ABA Signaling:From Perception to Action[J]. Mol Plant, 2016, 9(1): 21–33. DOI:10.1016/j.molp.2015.09.015 |
| [14] | Hodge CD, Edwards RA, Markin CJ, et al. Covalent Inhibition of Ubc13 Affects Ubiquitin Signaling and Reveals Active Site Elements Important for Targeting[J]. ACS Chem Biol, 2015, 10(7): 1718–1728. DOI:10.1021/acschembio.5b00222 |
| [15] | Ciechanover A, Stanhill A. The complexity of recognition of ubiquitinated substrates by the 26S proteasome[J]. Biochim Biophys Acta, 2014, 1843(1): 86–96. DOI:10.1016/j.bbamcr.2013.07.007 |
| [16] | Vierstra RD. The ubiquitin-26S proteasome system at the nexus of plant biology[J]. Nat Rev Mol Cell Biol, 2009, 10(6): 385–397. DOI:10.1038/nrm2688 |
| [17] | Takiuchi T, Nakagawa T, Tamiya H, et al. Suppression of LUBAC-mediated linear ubiquitination by a specific interaction between LUBAC and the deubiquitinases CYLD and OTULIN[J]. Genes Cells, 2014, 19(3): 254–272. DOI:10.1111/gtc.12128 |
| [18] | Xu R, Li Y. Control of final organ size by Mediator complex subunit 25 in Arabidopsis thaliana[J]. Development, 2011, 138(20): 545–4554. DOI:10.1242/dev.071423 |
| [19] | Klein AM, Cobb MH. ERK5 signaling gets XIAPed:a role for ubiquitin in the disassembly of a MAPK cascade[J]. EMBO J, 2014, 33(16): 1735–1736. DOI:10.15252/embj.201489205 |
| [20] | Lanctot AA, Peng CY, Pawlisz AS, et al. Spatially dependent dynamic MAPK modulation by the Nde1-Lis1-Brap complex patterns mammalian CNS[J]. Dev Cell, 2013, 25(3): 241–255. DOI:10.1016/j.devcel.2013.04.006 |
| [21] | Randall RS, Sornay E, Dewitte W, et al. AINTEGUMENTA and the D-type cyclin CYCD3;1 independently contribute to petal size control in Arabidopsis:evidence for organ size compensation being an emergent rather than a determined property[J]. J Exp Bot, 2015, 66(13): 3991–4000. DOI:10.1093/jxb/erv200 |
| [22] | Song XJ, Huang W, Shi M, et al. A QTL for rice grain width and weight encodes a previously unknown RING-type E3 ubiquitin ligase[J]. Nat Genet, 2007, 39(5): 623–630. DOI:10.1038/ng2014 |
| [23] | Diao W, Yang X, Zhou H. Purification, crystallization and preliminary X-ray data collection of the N-terminal domain of the 26S proteasome regulatory subunit p27 and its complex with the ATPase domain of Rpt5 from Mus musculus[J]. Acta Crystallogr F Struct Biol Commun, 2014, 70(Pt5): 611–615. DOI:10.1107/S2053230X14006815 |
| [24] | Kurepa J, Wang S, Li Y, et al. Loss of 26S proteasome function leads to increased cell size and decreased cell number in Arabidopsis shoot organs[J]. Plant Physiol, 2009, 150(1): 178–189. DOI:10.1104/pp.109.135970 |
| [25] | Eloy NB, Gonzalez N, Van Leene J, et al. SAMBA, a plant-specific anaphase-promoting complex/cyclosome regulator is involved in early development and A-type cyclin stabilization[J]. Proc Natl Acad Sci USA, 2012, 109(34): 13853–13858. DOI:10.1073/pnas.1211418109 |
| [26] | Folsom JJ, Begcy K, Hao X, et al. Rice fertilization-Independent Endosperm1 regulates seed size under heat stress by controlling early endosperm development[J]. Plant Physiol, 2014, 165(1): 238–248. DOI:10.1104/pp.113.232413 |
| [27] | Eckert C, Offenborn JN, Heinz T, et al. The vacuolar calcium sensors CBL2 and CBL3 affect seed size and embryonic development in Arabidopsis thaliana[J]. Plant J, 2014, 78(1): 146–156. DOI:10.1111/tpj.12456 |
| [28] | Hirsch CN, Flint-Garcia SA, Beissinger TM, et al. Insights into the effects of long-term artificial selection on seed size in maize[J]. Genetics, 2014, 198(1): 409–421. DOI:10.1534/genetics.114.167155 |
| [29] | Yu F, Li J, Huang Y, et al. FERONIA receptor kinase controls seed size in Arabidopsis thaliana[J]. Mol Plant, 2014, 7(5): 920–922. DOI:10.1093/mp/ssu010 |
| [30] | Li N, Li Y. Maternal control of seed size in plants[J]. J Exp Bot, 2015, 66(4): 1087–1097. DOI:10.1093/jxb/eru549 |
| [31] | Kou C, Gao X, Li LQ, et al. Composition and Selection of TaGW2-6A Alleles for Wheat Kernel Weight[J]. Acta Agronomica Sinica, 2015, 41(11): 1640. DOI:10.3724/sp.j.1006.2015.01640 |
| [32] | Qin L, Hao C, Hou J, et al. Homologous haplotypes, expression, genetic effects and geographic distribution of the wheat yield gene TaGW2[J]. BMC Plant Biol, 2014, 14: 107. DOI:10.1186/1471-2229-14-107 |
| [33] | Hong Y, Chen L, Du LP, et al. Transcript suppression of TaGW2 increased grain width and weight in bread wheat[J]. Funct Integr Genomics, 2014, 14(2): 341–349. DOI:10.1007/s10142-014-0380-5 |
| [34] | Kim K H, Shin S H, Lee HS, et al. Relationship between pre-harvest sprouting and functional markers, TaVp-1A, TaSdr-B1 and TaPHS1 in Korean wheat cultivars[J]. Research on Crops, 2014, 15(3): 604. DOI:10.5958/2348-7542.2014.01384.9 |


 张萌,汉族,山东泰安人,1990年11月出生。2006年本科就读于青岛大学,2010年考入山东农业大学生命科学学院,硕博连读。读博期间的研究方向为植物抗逆与分子基础,主要研究内容为泛素系统关键组分TaUb2和TaPUB1在植物抗逆方面 (包括非生物胁迫和生物胁迫方面) 的机制研究。相关文章发表在《Plant Physiology and Biochemistry》、《Physiological and Molecular Plant Pathology》、《Plant Science》等杂志上。2015年进入济宁医学院出生缺陷研究与转化协同创新中心工作至今,现主要从事临床基因扩增检验实验室基因检测相关工作
张萌,汉族,山东泰安人,1990年11月出生。2006年本科就读于青岛大学,2010年考入山东农业大学生命科学学院,硕博连读。读博期间的研究方向为植物抗逆与分子基础,主要研究内容为泛素系统关键组分TaUb2和TaPUB1在植物抗逆方面 (包括非生物胁迫和生物胁迫方面) 的机制研究。相关文章发表在《Plant Physiology and Biochemistry》、《Physiological and Molecular Plant Pathology》、《Plant Science》等杂志上。2015年进入济宁医学院出生缺陷研究与转化协同创新中心工作至今,现主要从事临床基因扩增检验实验室基因检测相关工作