2. 济宁医学院基础医学院, 济宁 272067
2. School of Basic Medicine Sciences, Jining Medical University, Jining 272067, China
miRNAs是真核生物中普遍存在的非编码RNA分子,主要通过与其靶基因mRNA的3’-UTR不完全配对,抑制靶基因mRNA的翻译,从而参与生物的发育、增值、周期、凋亡等重要过程[1-3]。研究证实miR-34c在疾病的发生发展过程中发挥重要作用。Yang等[4]研究发现miR-34c在乳腺肿瘤细胞和组织中的表达下调,过表达miR-34c能明显抑制乳腺癌细胞的转移与入侵。Li等[5]研究发现miR-34c在鼻咽癌细胞及临床标本中的表达降低,进一步体外实验发现miR-34c可抑制鼻咽癌细胞的生长和迁移。而关于miR-34c在脑缺血损伤中的研究较少。本研究中,我们制备大鼠局灶性脑缺血模型,分别在缺血2、6、24h后,分别检测miR-34c及其靶基因的表达变化,为后续深入研究miR-34c在缺血损伤过程中的具体作用及作用机制提供前期实验基础。
1 材料与方法 1.1 实验动物实验所需大鼠为SPF级雄性Wistar大鼠,购自山东鲁抗医药股份有限公司。实验动物的饲养和管理依照国家实验动物饲养管理及济宁医学院实验动物管理条例执行。实验动物饲养室的温度控制在22~26 ℃,湿度在50%~60%。实验过程除相关因素所需外,实验动物均自由摄食和饮水,在不影响实验要求和实验结果的基础上实施替代、减少、优化的“3R”原则。
1.2 局灶性脑缺血MCAO模型的制备15只Wistar大鼠饲养到鼠龄6~7周,体重180~200g时,通过大脑中动脉阻塞 (middle cerebral artery occlusion,MCAO) 法制备局灶性脑缺血模型,操作简述如下:大鼠经10%水合氯醛 (0.3ml/100g) 腹腔注射麻醉后,暴露右侧劲总动脉、劲外动脉、劲内动脉,结扎颈总动脉和颈外动脉。沿颈内动脉缓慢插入栓线,遇一定阻力停止进线,插入长度约 (18±2) mm。用缝线结扎并固定渔线,缝合皮肤。分别选5只在大脑中动脉阻塞2 h、6h及24h后,取相应大鼠海马脑组织进行相关实验。5只大鼠进行假手术不插入线栓,其余步骤同上。
1.3 miR-34c表达检测Trizol法提取上述海马组织的总RNA,紫外吸收测定法和甲醛变性电泳检测总RNA的浓度和纯度。利用miRNA cDNA第一链合成试剂盒 (天根生化科技有限公司) 将总RNA逆转录成cDNA。再利用miRNA荧光定量试剂盒 (天根生化科技有限公司) 对miR-34c的表达进行检测。qRT-PCR反应体系 (20μl):2×Premix缓冲液10μl,10μM特异引物0.6μl,10μM通用引物0.6μl,cDNA 2μl,dd H2O 6.8μl。将以上反应体系加入96孔反应板内,同时设未加模板的阴性对照孔,反应在罗氏荧光定量PCR仪 (Roche 480) 进行。qRT-PCR反应条件:95 ℃ 15min; 95℃ 10s,60 ℃ 20s,72 ℃ 30s,40个循环;37 ℃保存。计算机自动分析每组miR-34c和内参照U6的CT值,利用公式计算miR-34c表达的相对水平。每个反应设3个复孔,结果为3次实验的平均值。
1.4 miR-34c-5p靶基因的预测利用生物网站公布的数据库miRBase (http://www.mirbase.org/)、TargetScan (http://www.targetscan.org/) 及miRDB (http://mirdb.org/miRDB/) 对miR-34c可能调控的靶基因进行预测。然后利用Venny 2.0将3个数据库所检索到的靶基因进行交集 (http://bioinfogp.cnb.csic.es/tools/venny/index.html)。进一步通过基因功能注释 (https://www.ncbi.nlm.nih.gov/pubmed) 与文献检索,挑选miR-34c可能的靶基因。
1.5 RT-PCR检测靶基因在mRNA水平的表达利用FastQuant RT kit with gDNase (天根生化科技有限公司) 将所提总RNA逆转录成cDNA,首先配置去除gDNA体系 (10μl):总RNA 1μg,5×g DNA Buffer 2μl,dd H2O补足到10μl。混匀,42℃孵育3min。之后置于冰上。然后配置反转录体系 (20μl):10×Fast Buffer 2μl,RT Enzyme Mix 1μl,FQ-RT Primer Mix 2μl,dd H2O 10μl,混匀后加入去除gDNA体系内,42℃孵育15min,然后95℃变性3min。
将上述逆转录的cDNA进行PCR扩增,扩增体系 (20μl) 如下:2 × PCR Mix 10μl,10μM上游引物0.4μl,10μM下游引物0.4μl,cDNA模板1μl,dd H2O 8.2μl。扩增条件为:94℃ 3min;94℃ 40s,55℃ 40s,72℃ 50s,30个循环;72℃ 10min,最后4℃保存。同时以β-actin为内参对照 (引物序列见表 1)。PCR扩增后,扩增产物进行琼脂糖凝胶电泳 (100V,30min),电泳结束后在凝胶扫描仪上记录实验结果,并利用软件对电泳条带进行分析。
| 表 1 引物序列及扩增片段大小 |
利用SuperReal PreMix Plus试剂盒 (天根生化科技有限公司) 将上述逆转录的cDNA进行qRT-PCR扩增 (20μl):上游引物0.6μl,下游引物0.6μl,模板2μl,dd H2O 6.8μl,2×SYBR Premix Ex Taq 10μl。定量反应在LC480荧光定量PCR仪内,反应程序为:预变性95℃ 15min;变性95℃ 10s,退火60℃ 20s,延伸72℃ 20s,40个循环。其中β-actin为内参基因。结果为3次实验结果的平均值。应用相对定量法2-△△Ct计算获得目的基因的相对表达水平。
1.7 统计分析采用GraphPad Prism5.0软件对所得实验数据进行分析处理。实验结果用x±s表示,组间比较采用t检验,P<0.05为差异有统计学意义。
2 结果 2.1 miR-34c在大鼠脑缺血模型不同时间点的表达情况首先利用qRT-PCR方法检测miR-34c在大鼠局部脑缺血2h,6h及24h模型中的表达变化。与对照相比, 当缺血2h时,miR-34c的表达量下降了27.4%,差异具有统计学意义 (P<0.05);缺血6h时,miR-34c的表达量下降了57.76%,差异具有统计学意义 (P<0.05);缺血时间达到24h,miR-34c的表达量下降了74.16%,差异具有统计学意义 (P<0.05)。结果表明随着大鼠局部脑缺血时间的增加,miR-34c的表达呈明显的下降趋势,提示miR-34c在大鼠局部脑缺损伤血过程中起到重要的保护作用。见图 1。
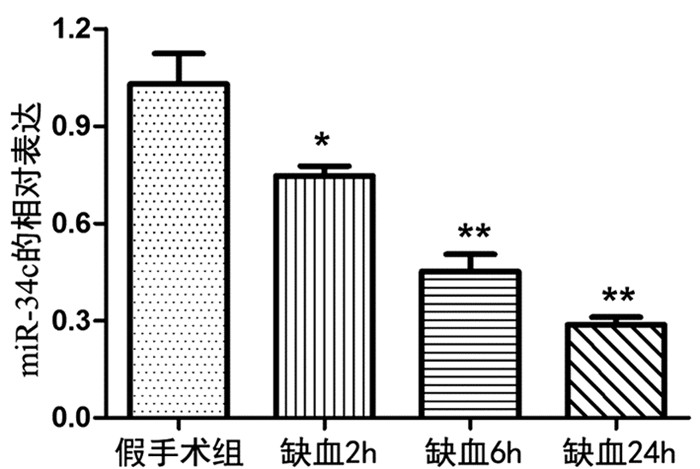
|
图 1 miR-34c在大鼠脑缺血不同时间点模型中的表达 注:与假手术组相比,*P<0.05;**P<0.01 |
利用网上数据库 (TargetScan,miRbase,miRDB) 预测miR-34c的靶基因。由于不同数据库的预测算法存在细微差别,因此,3个数据库预测的miR-34c靶基因数目不相同。然后利用Venny 2.0将通过3个数据库预测到的基因进行交集分析。结果如图 2,在3个数据库中27个基因均预测到为miR-34c的靶基因。
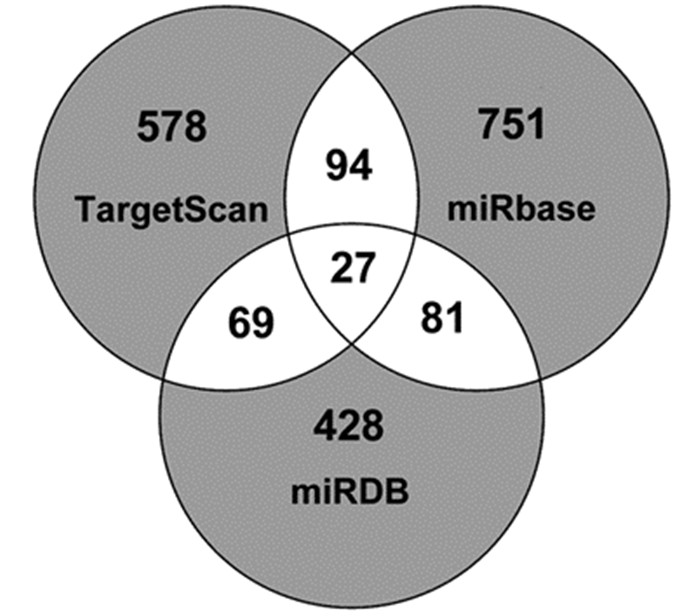
|
图 2 3个数据库预测到的miR-34c靶基因的交集 |
通过基因功能注释 (GO:Gene Oncology) 与文献检索,从上述交集的27个靶基因中进一步挑选4个基因做进一步的实验验证,这4个基因分别为:Hspa1b (Heat shock 70kDa protein 1B),Cacna2d1(calcium channel, delta subunit 1),Sperping1(serpin peptidase inhibitor,member 1) 及Cntn2 (Contactin-2)。表 2分别列出了miR-34c与这4个靶基因3’-UTR区匹配的情况。
| 表 2 miR-34c与靶基因匹配的碱基 |
利用RT-PCR方法检测4个靶基因在大鼠局部脑缺血2h,6h及24h模型中的表达变化。结果如图 3,靶基因Hspa1b,Cacna2d1,Sperping1及Cntn2均随着缺血时间的增加,其表达明显呈上升趋势。Hspa1b基因的表达在缺血2h明显上升,缺血6h其表达量最大,缺血24h表达量反而下降。Cacna2d1基因的表达在缺血2h显著上升,且在缺血24h内一直保持较高的表达量。基因Sperping1的表达在缺血2h上升不明显,缺血6h表达显著上升,且在24h表达持续升高。基因Cntn2的表达趋势与Sperping1的表达一致,随着缺血时间的增加其表达持续升高。这些结果表明这4个基因在大鼠脑局部缺血过程中发挥重要作用,而且其作用机制不尽相同。由于在缺血过程中随着缺血时间的增加miR-34c的表达呈明显下降趋势,而4个靶基因的表达呈明显上升趋势,所以进一步判断这些基因可能是miR-34c的靶基因,他们可能是通过miR-34c的调控作用来发挥功能的。

|
图 3 RT-PCR检测靶基因的表达变化 注:a代表RT-PCR检测结果;b代表凝胶条带的读数值,与假手术组相比,*P<0.05;**P<0.01;***P<0.001 |
进一步利用qRT-PCR方法检测4个靶基因在大鼠局部脑缺血2h,6h及24h模型中的表达变化。检测结果与RT-PCR方法基本一致。Hspa1b基因的表达量在缺血2h时增加了4.6倍,缺血6h增加了8.6倍,缺血24h虽然升高,但与6h相比没有显著差异。Cacna2d1基因的表达量在缺血2h上升了2.4倍,缺血6h上升了5.71倍,缺血24h上升了6.68倍。基因Sperping1的表达在缺血2h上升没有达到统计学意义,缺血6h具有统计学意义,24h表达显著升高,是对照的11.45倍。基因Cntn2的表达趋势同样是24h表达显著,是对照的4.19倍。qRT-PCR结果进一步表明这4个靶基因在大鼠局部脑缺血损伤过程中起到重要作用。见图 4。

|
图 4 qRT-PCR检测靶基因的表达变化 注:与假手术组相比,*P<0.05;**P<0.01;***P<0.001 |
缺血性脑损伤为临床神经系统常见疾病,可引起缺血组织的细胞缺血,最终导致细胞坏死,造成不可逆的脑损伤。目前研究揭示可能与炎症反应、细胞凋亡、持程序性坏死等因素有关,但具体的机制还不清楚。近年来研究揭示,大脑局部缺血可引起脑组织miRNAs的表达谱发生显著的变化,表明miRNAs参与了脑缺血的损伤过程。Dharap等[6]研究显示,大鼠脑缺血后大脑皮层的miRNAs快速发生变化,缺血后6h至3d,有20个miRNAs的表达发生改变,其中至少有9个miRNAs的表达差异显著。Lee等[7]证实大鼠脑缺血3h后,miR-200家族 (miR-200a, miR-200b, miR-200c, miR-141 and miR-429) 和miR-182家族 (miR-182, miR-183 and miR-96) 表达上调;脑缺血24h后,miR-19和miR-681表达上调,而miR-468表达下调。本研究中我们检测了miR-34c在大鼠局部脑缺血后1h,2h及24h后的表达,发现随着缺血时间的增长,miR-34c在海马组织中的表达呈明显下降趋势,表明miR-34c在大脑局部缺血过程发挥重要保护作用。
miRNA主要是通过调控其不同靶基因的表达来调控各种生物过程的,其中生物信息学方法是预测miRNA靶基因的重要方法。Zhang等[8]利用生物信息学软件预测miR-34c的靶基因,预测到3个基因:锌指蛋白148(znf148),Kruppel样因子4(KLF4) 和血小板衍生生长因子受体α(PDGFRA),这3个基因对精子发生和雄性生殖发育相关。Song等[9]预测蛋白激酶C底物 (MARCKS) miR-34c-3p特异靶基因,miR-34c-3p通过调控MARCKS基因的表达来抑制肝癌细胞的迁移和侵袭。本研究中我们通过3个数据库、数据库交集及靶基因的功能富集,最终筛选4个基因作为miR-34c的靶基因。并进一步通过RT-PCR方法检测到这几个靶基因在大鼠局部脑缺血模型中的表达均随着缺血时间的增加而成明显上升的趋势,进一步表明这4个基因可能是miR-34c的靶基因。我们将在后续的研究中验证这4个靶基因的功能,进一步阐述miR-34c的功能意义。
综上所述,本研究中我们检测到miR-34c在大鼠局部脑缺血不同时间点模型中的表达变化,并利用生物信息学方法预测miR-34c的靶基因,以及检测到靶基因在大鼠局部脑缺血不同时间点模型中的表达情况。这为后续深入研究miR-34c在缺血损伤中的作用机制提供重要的前期实验基础。
| [1] | Katz MG, Fargnoli AS, Kendle AP, et al. The role of microRNAs in cardiac development and regenerative capacity[J]. Am J Physiol Heart Circ Physiol, 2016, 310(5): H528–H541. DOI:10.1152/ajpheart.00181.2015 |
| [2] | Lin C, Huang F, Shen G, et al. MicroRNA-101 regulates the viability and invasion of cervical cancer cells[J]. Int J Clin Exp Pathol, 2015, 8(9): 10148–10155. |
| [3] | Iqbal N, Mei J, Liu J, et al. miR-34a is essential for p19(Arf)-driven cell cycle arrest[J]. Cell Cycle, 2014, 13(5): 792–800. DOI:10.4161/cc.27725 |
| [4] | Yang S, Li Y, Gao J, et al. MicroRNA-34 suppresses breast cancer invasion and metastasis by directly targeting Fra-1[J]. Oncogene, 2013, 32(36): 4294–4303. DOI:10.1038/onc.2012.432 |
| [5] | Li YQ, Ren XY, He QM, et al. MiR-34c suppresses tumor growth and metastasis in nasopharyngeal carcinoma by targeting MET[J]. Cell Death Dis, 2015, 6: e1618. DOI:10.1038/cddis.2014.582 |
| [6] | Dharap A, Vemuganti R. Ischemic pre-conditioning alters cerebral microRNAs that are upstream to neuroprotective signaling pathways[J]. J Neurochem, 2010, 113(6): 1685–1691. DOI:10.1111/j.1471-4159.2010.06735.x |
| [7] | Lee ST, Chu K, Jung KH, et al. MicroRNAs induced during ischemic preconditioning[J]. Stroke, 2010, 41(8): 1646–1651. DOI:10.1161/STROKEAHA.110.579649 |
| [8] | Zhang X, Zhao W, Li C, et al. Differential expression of miR-34c and its predicted target genes in testicular tissue at different development stages of swine[J]. Asian-Australasian Journal of Animal Sciences, 2015, 28(11): 1532–1536. DOI:10.5713/ajas.15.0047 |
| [9] | Song J, Wang Q, Luo Y, et al. miR-34c-3p inhibits cell proliferation, migration and invasion of hepatocellular carcinoma by targeting MARCKS[J]. Int J Clin Exp Pathol, 2015, 8(10): 12728–12737. DOI:10.3892/ijo.2015.3112 |



