2. 济宁医学院附属医院, 济宁 272029
2. The Affiliated Hospital of Jining Medical University, Jining 272029, China
近年来随着分子生物学的发展,基因工程和细胞移植在心肌梗死 (myocardial infarction,MI) 研究方面一直是非常有前景的治疗策略。细胞移植特别是骨髓间充质干细胞 (bone marrow mesenchymal stem cells, BMSCs),因其易获得、增殖能力强、多向分化潜能等特性,在MI的研究中被认为是理想的种子细胞。血管内皮生长因子165(vascular endothelial growth factor 165,VEGF165) 因其具有保护心脏[1]、促进血管生成作用,在缺血性心脏病领域被广泛研究, 并被批准应用于临床[2]。研究表明构建携带VEGF165基因的腺病毒在改善缺血性心衰的心肌收缩力方面具有非常显著的作用[3];使用VEGF165基因修饰BMSCs移植治疗MI具有一定疗效[4-6]。最新研究报道,将已分化的心肌样细胞移植治疗小鼠心肌梗死可以显著改善其梗死后心脏功能和心肌收缩力[7]。本文将携带VEGF165基因的腺病毒 (Ad-VEGF165) 转染至已分化心肌样细胞, 探讨对其增殖能力及表达目的蛋白影响的实验研究,旨在为其进一步应用于MI治疗提供理论及技术支持。
1 材料和方法 1.1 材料 1.1.1 实验动物与腺病毒雄性SD大鼠,4周龄,体重80-100g,购自山东省动物实验中心。腺病毒:Ad-VEGF165由“汉恒生物科技 (上海) 有限公司”构建合成。
1.1.2 试剂DMEM/F12培养基、1×PBS、0.25%胰蛋白酶购自美国Gibco公司;青-链霉素、肝素购自北京solarbio公司;兔IgG1同型对照抗体购自美国Bioss Inc公司;兔抗大鼠CD31-PE、兔抗大鼠CD45-FITC购自美国Bioss Inc公司;小鼠IgG2a同型对照抗体、小鼠抗大鼠CD90-PerCP购自德国Miltenyi Biotec公司;小鼠IgG1同型对照抗体、小鼠抗大鼠CD44-FITC购自美国Bio-Rad公司;SD大鼠骨髓间充质干细胞成骨、成脂诱导分化培养基购自美国Cyagen公司;CCK-8检测试剂盒购自日本Dojindo公司;人VEGF165酶联免疫试剂盒购自美国Abcam公司;5-氮杂胞苷 (5-AZA)、碱性成纤维细胞生长因子、胎牛血清购自美国Sigm公司;逆转录试剂盒、SYBR Green PCR试剂盒购自广州复能基因公司;引物:由生工生物工程 (上海) 股份有限公司设计合成 (表 1)。
| 表 1 基因上游、下游引物序列 |
颈椎脱位法处死4周龄SD大鼠并置于75%乙醇消毒5min;超净台中分离SD大鼠股骨,剃净置于9cm培养皿中。手术剪迅速剪开骨端,10ml注射器抽吸无血清培养基反复冲洗骨髓腔,直至变白。将冲洗液置于15ml离心管,1200r/min离心8min,弃上清。将沉淀用含10%胎牛血清的培养基重悬后加入培养瓶中,置入细胞培养箱培养。24h半量换液,2~3d全量换液; 倒置荧光显微镜观察细胞生长状态,当细胞融合至90%左右时,1:2传代。
1.2.2 BMSCs的鉴定1) 诱导分化能力:将3代BMSCs接种于六孔板 (105个/孔),按照成骨、成脂诱导说明书进行成骨、成脂诱导。2) 流失细胞术检测:BMSCs表面抗原:取生长状态良好的3代BMSCs (1×106cells/ml)100μl,分别加入荧光素标记的抗体 (CD31-PE、CD44-FITC、CD45-FITC、CD90-PerCP) 和相对应的同型对照抗体,混匀,4°避光孵育30min。洗涤2次,上流式细胞仪检测。
1.2.3 BMSCs诱导分化为心肌样细胞取生长状态良好的3代BMSCs,接种于6孔板 (105个/孔),使用含有5-氮杂胞苷 (5-AZA,10μM)、碱性成纤维细胞生长因子 (bFGF,10ng/ml) 无胎牛血清 (FBS) 的培养基培养24h后,PBS冲洗,使用含bFGF (10ng/ml)、5%FBS的培养基继续培养3周,每2~3d换液1次[8]。倒置荧光显微镜观察BMSCs分化状态。
1.2.4 qPCR检测心肌样细胞特异性因子的表达使用Trizol试剂提取BMSCs和心肌样细胞的总RNA,将提取的总RNA使用逆转录试剂盒根据说明书获得cDNA,通过使用管家基因 (GAPDH) 作为对照分析心肌样细胞特异性因子 (ACTN-2,Cx43,GATA4,cTnT) 的表达。反应条件为:预变性95℃ 10min;变性95℃ 10s;退火60℃ 20s;延伸72℃ 30s, 45个循环;溶解曲线分析72℃~95℃ 0.5 ℃/6s;降温25℃ 30s,使用2-ΔΔCt法评估相关基因的表达水平。
1.2.5 Ad-VEGF165感染心肌样细胞将培养于6孔板内已诱导3周的心肌样细胞,以MOI值为80进行腺病毒感染,实验分为3组:Ad-VEGF165感染已分化的心肌样细胞作为实验组;未携带VEGF165基因的腺病毒感染已分化的心肌样细胞作为空载体组;已分化的心肌样细胞作为空白对照组。在感染24、36h后倒置荧光显微镜下观察实验组、空载体组荧光分布情况,评估腺病毒对已分化的心肌样细胞的感染效率。
1.2.6 心肌样细胞表达VEGF165及对其活性的影响取3组心肌样细胞分别接种于96孔板 (104个/孔),每组设3个复孔,收集1周内各孔上清液,ELISA法检测心肌样细胞表达VEGF165的情况;另取已分为3组的心肌样细胞接种于96孔板,每组设3个复孔,于培养后1~7d分别使用CCK-8法检测心肌样细胞的活性。
1.3 统计学分析数据采用SPSS 19.0统计软件进行统计学分析,计量资料使用x±s表示,多组间比较采用单因素方差分析,组间多重比较:若资料方差齐,采用LSD-t检验;若资料方差不齐,采用Tamhane's T2检验,P<0.05具有统计学意义。
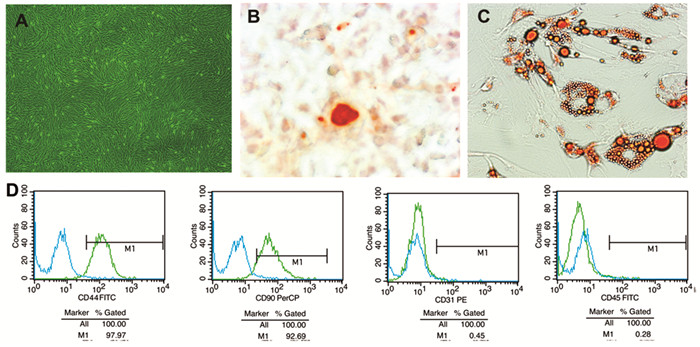
2 结果 2.1 BMSCs提取、培养、鉴定倒置相差显微镜下观察,接种12h BMSCs可见部分贴壁生长,呈细长梭形,24h首次半量换液,随培养时间延长,细胞局部形成集落,细胞群呈旋风样排列,1周左右即可达到80%融合 (图 1A)。BMSCs成骨、成脂诱导分化成功 (图 1B-C);流式细胞术细胞表面抗原检测包封BMSCs的细胞表型:CD44:97.97%;CD90:92.69%;CD31:0.45%;CD45:0.28%,均符合BMSCs细胞特性 (图 1D)。
|
图 1 BMSCs提取、培养、诱导分化 注:A.3代BMSCs (40×); B.诱导BMSCs分化为成骨细胞 (茜素红染色,400×); C.诱导BMSCs分化为脂肪细胞 (油红O染色,400×); D.BMSCs流式细胞表型 (CD44;CD90;CD31;CD45) 直方图 |
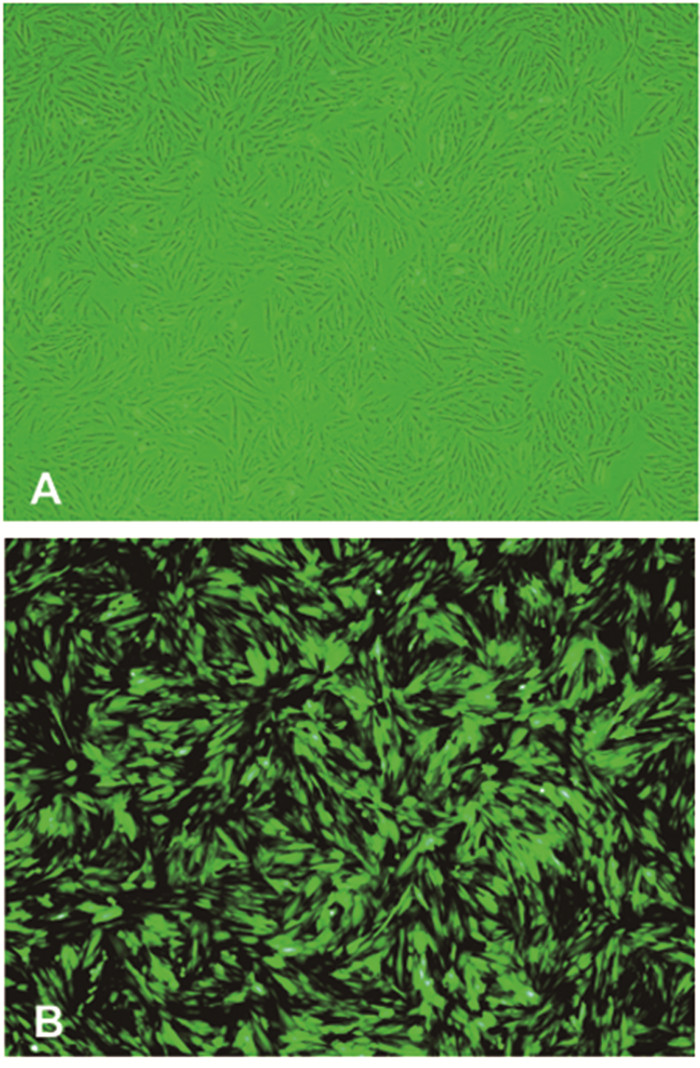
经过5-AZA处理后,BMSCs逐步分化为心肌样细胞。在使用5-AZA处理时,部分细胞脱落,剩余细胞增殖。1周后,大约30%的剩余细胞已完成扩增并呈“短棒样”、“珠样”结构。3周后细胞间互相连接并出现肌管样结构,细胞呈梭形,具有显著的方向性 (图 3 A)。qPCR检测心肌样细胞特异性因子的表达显示,经5-AZA处理后的已分化心肌样细胞 (ACTN-2,Cx43,GATA4,cTnT) mRNA水平均高于未处理的BMSCs见图 2。
|
图 3 心肌样细胞及携带VEGF165基因腺病毒 注:A.心肌样细胞;B.倒置荧光相差显微镜下观察GFP的表达 |

|
图 2 qPCR检测特异性因子的表达 注:*P<0.05 |
Ad-VEGF165转染心肌样细胞,24h后GFP表达率可达70%(图 3 B),且与未携带VEGF165基因腺病毒感染的心肌样细胞表达绿色荧光蛋白无明显差异。
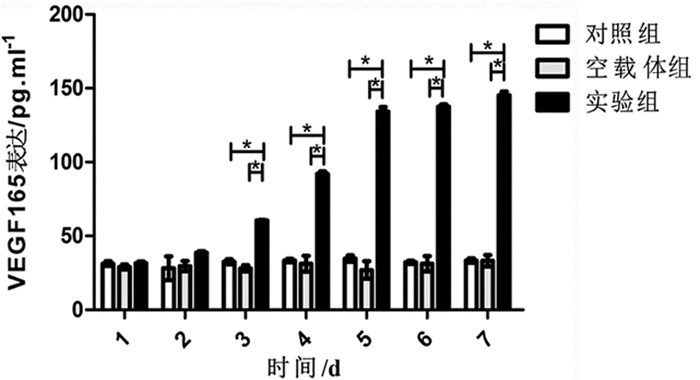
2.4 转染后心肌样细胞VEGF165的表达ELISA检测VEGF165表达,发现空白对照组及空载体组呈低表达,实验组呈高表达,且差异具有统计学意义 (P<0.05).进一步比较可看出,3组在第2天时VEGF165表达无显著性差异 (P>0.05),2d后出现显著性差异 (P<0.05) 见图 4。
|
图 4 心肌样细胞在不同时相点VEGF165的表达 注:*P<0.05 |
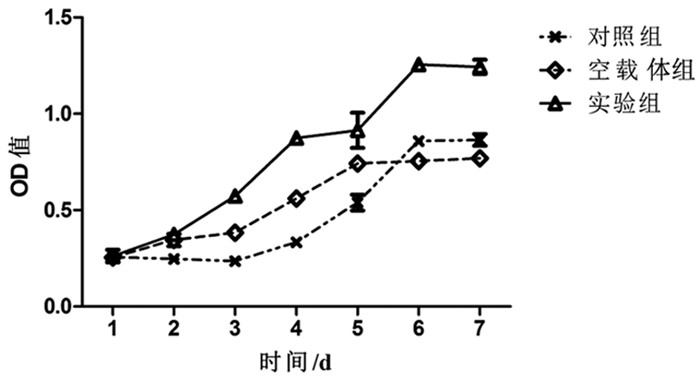
通过CCK-8法检测3组细胞增殖活性,发现转染后心肌样细胞的增殖活性要优于对照组及空载体组,差异具有统计学意义 (P<0.05),说明VEGF165对心肌样细胞活性具有一定的促进作用。见图 5。
|
图 5 Ad-VEGF165心肌样细胞在不同时相点的增殖活性 |
MI主要是由于心脏局部血管供血障碍导致其供应区域的心肌组织出现代谢障碍而导致的一系列综合征。应用干细胞移植有可能取代受损心肌细胞并建立新的血管来供应血运[9]:当前关于MI基础研究的热点主要是促进移植的BMSCs对MI的作用即将未分化的BMSCs体外转染目标生长因子或种植于某种生物材料上,移植至具有心梗的动物模型中,检测其对MI的治疗作用,然而大量动物实验及临床试验并没有得到满意的临床效果[10-12],主要原因可能是BMSCS在病变部位分化为心肌细胞的能力较弱,不能提供足够的新生心肌细胞进行损伤后修复[13]。最新研究表明:BMSCs诱导分化后的心肌样细胞在心脏功能改善上要比移植BMSCs具有更显著的作用[7]。
血管内皮生长因子 (vascular endothelial growth factor, VEGF),作为一种特殊的细胞内皮分裂素,因其具有血管再生作用,近些年来在医学领域被广泛研究[14]。然而,VEGF165为小分子蛋白,因其半衰期短[15],导致不完全的血管再生[16],限制其进一步应用。基因工程可以克服这一障碍,在治疗缺血性心脏病方面,携带VEGF165的基因载体不仅可以增强血管再生[17]、改善心脏功能[3],还可以促进细胞增殖、下调细胞因子诱导的内皮激活和下游的炎症反应[18]。故我们构建Ad-VEGF165使其可以克服其自身半衰期短导致的不完全血管再生,然后基因修饰心肌样细胞。实验中我们发现VEGF165在心肌样细胞中是可以正常表达的,与空载体组和对照组比较,差异具有统计学意义 (P<0.05);另外我们使用CCK-8法检测VEGF165对心肌样细胞增殖活性,2d后发现细胞增殖活性明显优于空载体组和对照组 (P<0.05),提示心肌样细胞表达VEGF165后,可以增强心肌样细胞的增殖活性,有助于心肌样细胞的生存。
在这个实验中,研究的主要目的是探讨Ad-VEGF165基因修饰已分化心肌样细胞后对其目的蛋白的表达及细胞增殖活性的影响。实验中顺利提取、培养BMSCs;使用流式细胞术鉴定BMSCs表面抗原,并可将其诱导为脂肪细胞、成骨细胞和心肌样细胞。构建的Ad-VEGF165载体感染至已分化的心肌样细胞,ELISA检测目的蛋白VEGF165的表达,通过CCK-8法检测细胞增殖活性。研究证实感染后心肌样细胞的VEGF165的表达及增殖活性均优于对照组和空载体组。说明我们构建的Ad-VEGF165心肌样细胞不仅可以正常表达VEGF165,且对其细胞活性具有一定的促进作用。但实验中对Ad-VEGF165心肌样细胞在细胞活性以及目的蛋白表达方面未进行长期 (2w、3w、4w) 的观察研究,也未将其与正常心肌细胞或心衰心肌细胞共培养研究其相互作用,同时也未进行动物实验。故在相关方面还需进一步研究, 为今后其在MI治疗方面的体内细胞移植及体外验证提供更全面的实验和理论依据。
| [1] | Zhu H, Jiang X, Li X, et al. Intramyocardial delivery of VEGF165 via a novel biodegradable hydrogel induces angiogenesis and improves cardiac function after rat myocardial infarction[J]. Heart and Vessels, 2015, 31(6): 963–975. DOI:10.1007/s00380-015-0710-0 |
| [2] | Henry TD, Annex BH, McKendall GR, et al. The VIVA trial:Vascular endothelial growth factor in Ischemia for Vascular Angiogenesis[J]. Circulation, 2003, 107(10): 1359–1365. DOI:10.1161/01.cir.0000061911.47710.8a |
| [3] | Katz MG, Fargnoli AS, Kendle AP, et al. Gene therapy in cardiac surgery:clinical trials, challenges, and perspectives[J]. Ann Thorac Surg, 2016, 101(6): 2407–2416. DOI:10.1016/j.athoracsur.2015.12.004 |
| [4] | 常影, 李树岩, 董明慧. 骨髓间充质干细胞联合VEGF基因移植对AMI心肌细胞凋亡的影响[J]. 中国临床研究, 2012, 25(5): 420–423. |
| [5] | 陈国祥, 华平, 熊利华, 等. 腺病毒介导的肝细胞生长因子/血管内皮生长因子双基因转染骨髓间充质干细胞移植治疗心肌梗死[J]. 中国组织工程研究, 2012, 16(10): 1841–1845. DOI:10.3969/j.issn.1673-8225.2012.10.029 |
| [6] | 高峰, 张近宝, 周凯, 等. 血管内皮生长因子基因修饰骨髓间充质干细胞移植心肌梗死大鼠:高压氧干预促进治疗性血管生成[J]. 中国组织工程研究, 2012, 16(27): 5011–5016. DOI:10.3969/j.issn.2095-4344.2012.27.014 |
| [7] | Winters AA, Bou-Ghannam S, Thorp H, et al. Evaluation of multiple biological therapies for ischemic cardiac disease[J]. Cell Transplant, 2016, 25(9): 1591–1607. DOI:10.3727/096368916X691501 |
| [8] | Rahimi M, Zarnani AH, Mohseni-Kouchesfehani H, et al. Comparative evaluation of cardiac markers in differentiated cells from menstrual blood and bone marrow-derived stem cells in vitro[J]. Mol Biotechnol, 2014, 56(12): 1151–1162. DOI:10.1007/s12033-014-9795-4 |
| [9] | Li Y, Hiroi Y, Ngoy S, et al. Notch1 in bone marrow-derived cells mediates cardiac repair after myocardial infarction[J]. Circulation, 2011, 123(8): 866–876. DOI:10.1161/CIRCULATIONAHA.110.947531 |
| [10] | Balsam LB, Wagers AJ, Christensen JL, et al. Haematopoietic stem cells adopt mature haematopoietic fates in ischaemic myocardium[J]. Nature, 2004, 428(6983): 668–673. DOI:10.1038/nature02460 |
| [11] | Scherschel JA, Soonpaa MH, Srour EF, et al. Adult bone marrow-derived cells do not acquire functional attributes of cardiomyocytes when transplanted into peri-infarct myocardium[J]. Mol Ther, 2008, 16(6): 1129–1137. DOI:10.1038/mt.2008.64 |
| [12] | Murry C E, Soonpaa M H, Reinecke H, et al. Haematopoietic stem cells do not transdifferentiate into cardiac myocytes in myocardial infarcts[J]. Nature, 2004, 428(6983): 664–668. DOI:10.1038/nature02446 |
| [13] | Zhang GW, Liu XC, Li-Ling J, et al. Mechanisms of the protective effects of BMSCs promoted by TMDR with heparinized bFGF-incorporated stent in pig model of acute myocardial ischemia[J]. J Cell Mol Med, 2011, 15(5): 1075–1086. DOI:10.1111/j.1582-4934.2010.01070.x |
| [14] | Yä-Herttuala S, Martin JF. Cardiovascular gene therapy[J]. Lancet, 2000, 355(9199): 213–222. DOI:10.1016/S0140-6736(99)04180-X |
| [15] | Hughes GC, Biswas SS, Yin B, et al. Therapeutic angiogenesis in chronically ischemic porcine myocardium:comparative effects of bFGF and VEGF[J]. Ann Thorac Surg, 2004, 77(3): 812–818. DOI:10.1016/j.athoracsur.2003.09.060 |
| [16] | Salimath A S, Phelps E A, Boopathy A V, et al. Dual delivery of hepatocyte and vascular endothelial growth factors via a protease-degradable hydrogel improves cardiac function in rats[J]. PLoS One, 2012, 7(11): e50980. DOI:10.1371/journal.pone.0050980 |
| [17] | Zhang H, Yuan YL, Wang Z, et al. Sequential, timely and controlled expression of hVEGF165 and Ang-1 effectively improves functional angiogenesis and cardiac function in vivo[J]. Gene Ther, 2013, 20(9): 893–900. DOI:10.1038/gt.2013.12 |
| [18] | Kupatt C, Hinkel R, Vachenauer R, et al. VEGF165 transfection decreases postischemic NF-kappa B-dependent myocardial reperfusion injury in vivo:role of eNOS phosphorylation[J]. FASEB J, 2003, 17(6): 705–707. DOI:10.1096/fj.02-0673fje |



