Apelin受体 (putative receptor protein related to the angiotensin receptor AT1, APJ) 属于G蛋白偶联受体 (G-protein-coupled receptors, GPCRs) 家族,其内源性的配体Apelin是平衡心血管系统的关键因子[1-2],而Apelin-13是众多配体中与其亲和力较高、作用较强的肽[3]。研究表明,Apelin-APJ系统在心血管系统以外的神经系统、体液平衡、内分泌代谢等也发挥重要的作用[1, 4-9]。Scimia等[10]研究发现,Apelin能够显著降低由于长期压力导致的心肌肥厚和心力衰竭。作为GPCRs成员之一,Apelin受体主要是通过偶联G蛋白进而调节下游信号通路的,如Apelin-13诱导Apelin受体激活Gαi/o亚基促进cAMP的释放[11-12],在HEK293T细胞中,Apelin受体通过偶联Gαo/q亚基激活PKC途径[12]。虽然Apelin受体系统的生理作用取得了显著的成果,但Apelin受体与G蛋白的偶联机制至今还不清楚,有待进一步的深入研究。
本实验基于前期研究基础,以HEK293T细胞为研究对象,通过建立Apelin受体与各亚型G蛋白的过表达体系,利用荧光共振能量转移技术 (fluorescence resonance energy transfer technology, FRET)[13-14]实时、动态、连续的观察Apelin受体与G蛋白生理状态下的时空信息,为Apelin-13诱导的下游信号通路提供新的理论依据。报道如下。
1 材料与方法 1.1 材料HEK293T细胞购自ATCC (American Type Culture Collection, Rockville, MD, USA) 公司;实验中所需的质粒小提试剂盒等购自Takara公司;激动剂Apelin-13(EC50=0.37nM[15],人) 与孤啡肽 (Nociceptin/Orphanin FQ,EC50=12nM[16],人) 购自凤凰公司 (Phoenix Pharmaceuticals, Europe GMBH, and Germany);重组质粒Gαi1-YFP、Gαi2-YFP、Gαi3-YFP与Gαo-YFP由德国马尔堡大学Moritz Bünemann教授惠赠;pCFP-Gγ2重组质粒由英国华威大学陈京教授惠赠。
1.2 方法 1.2.1 细胞培养与实验分组HEK293T细胞用含有10% FBS的DMEM培养基,置于37℃ 5% CO2培养箱中培养。待细胞密度培养约90%时,传代至24孔板培养14~20h (细胞密度约为60%~70%),随机分为实验组与对照组 (见表 1),每组4孔,各实验小组加入100nM Apelin13刺激,对照组加入PBS缓冲液,分别探讨Apelin受体与不同亚型G蛋白 (Gαi1、Gαi2、Gαi3、Gαo、Gαq) 的偶联机制。选用Gγ2-CFP与没有标记目的蛋白的荧光标签,用以区分FRET信号是由蛋白互作产生的而不是由大分子随机运动碰撞产生的。重组质粒的瞬时转染利用转染试剂LipofectamineTM2000(Invitrogen公司) 与Opti-MEM严格依据其说明书操作。
| 表 1 实验分组 |
利用FRET技术实时观察Apelin受体与G蛋白在活细胞中的时空信息。FRET仪器使用OLYMPUS 1×71的倒置荧光显微镜 (10×、20×、40×),滤光片配有供体通道 (即青色荧光蛋白,CFP)、受体通道 (即黄色荧光蛋白,YFP)、能量共振转移通道 (即CFP-YFP-FRET)。仅瞬时转染供体的细胞,通过供体通道计算供体校正因子B;仅转染受体的细胞,通过受体通道计算受体校正因子A;将校正因子A、B值输入到仪器自带MetaFlour FRET 7.0软件的计算公式,得到校正后的FRET值[17-20]。FRET图片获取时,为降低荧光猝灭,采用曝光时间为300ms,频率为10Hz。实验组加入100nM Apelin13刺激,对照组加入PBS缓冲液,选定细胞感兴趣区域,扣除背景噪点,分别获取CFP[激发光:(436±10) nM,发射光:(480±20) nM]、YFP[激发光:(480±20) nM,发射光:(535±15) nM]、FRET[激发光:(436±10) nM,发射光:(535±15) nM]通道的图片。获取的图像利用MetaFlour FRET 7.0软件处理,由黑色到红色表示FRET信号逐渐增强[19-20]。在获取FRET图片的同时,可以得到相对应的CFP、YFP的荧光值,基于FRET工作原理,检测到的YFP的荧光值与CFP的荧光值比值代表FRET效率,而激动剂刺激前后FRET信号的变化表示为:△FRET=FYFP/CFP (刺激后)-FYFP/CFP (刺激前)。如为实时观察Apelin-13刺激前后,Apelin受体与G蛋白的相互作用产生的FRET现象的变化,本实验选用YFP嵌在Gαi1亚基的α螺旋区域 (αΑ-B-loop) 的重组质粒—Gαi1-YFP (C351Ⅰ),且对PTX不敏感。在HEK293T细胞中瞬时共转染Apelin受体、Gαi1-YFP、Gβ1Gγ2-CFP重组质粒,24h后进行FRET观察,每3s依次获取CFP、YFP、FRET 3通道图片及数据,待图像与数据均稳定后,加入终浓度为100nM Apelin-13激动剂刺激5min后,每3s依次获取CFP、YFP、FRET 3通道图片及数据 (其他实验组方法类似)。
1.3 统计学方法采用GraphPad Prism 5软件进行统计学分析。
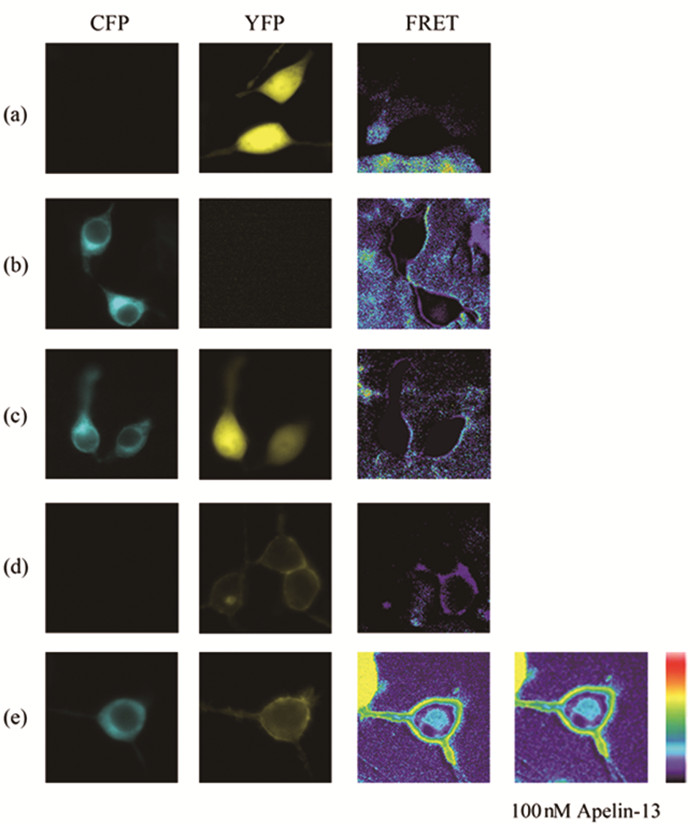
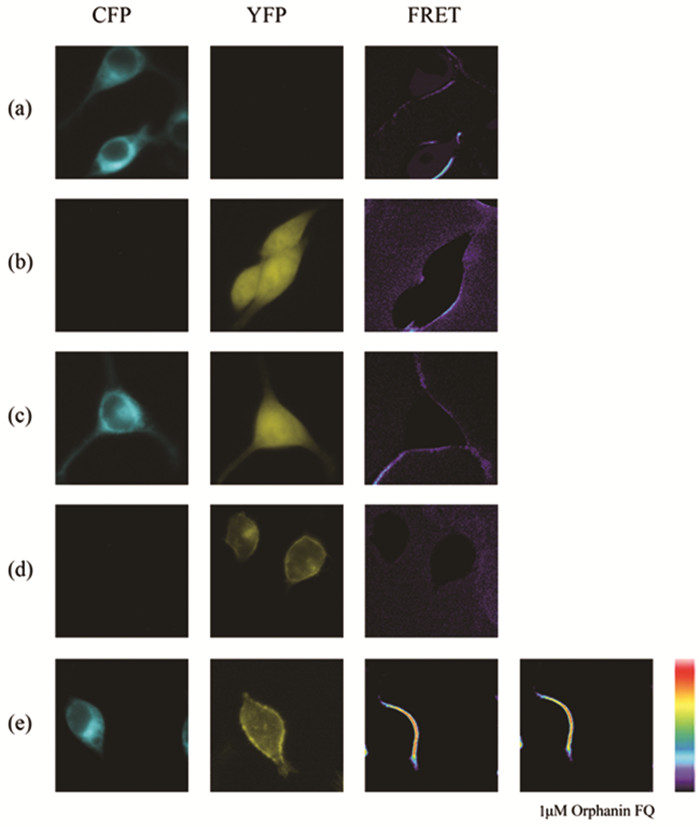
2 结果 2.1 Apelin受体不激活Gαi1蛋白FRET结果表明,激动剂Apelin-13刺激前后FRET信号几乎没有变化,但实验组 (共转染APJ、Gαi2/Gαi3-YFP、Gβ1Gγ2-CFP重组质粒的HEK293T细胞) 的FRET信号强于对照组 (peYFP-N1、Gγ2-CFP)[图 1;图 7-1]。依据FRET原理,实时分析FRET数据,推测Apelin-13刺激Apelin受体后不能够激活Gαi1蛋白。为进一步证实Gαi1-YFP、Gβ1Gγ2-CFP等重组质粒是工作的,我们利用FRET技术监测孤啡肽受体 (orphan opioid-like receptor,ORL1) 与Gαi1蛋白的。瞬时共转染ORL1、Gαi1-YFP、Gβ1Gγ2-CFP的HEK293T细胞,依据上述实验方法,依次获取刺激 (激动剂终浓度为1μM Orphanin FQ) 前后的FRET图像与数据,发现加入激动剂孤啡肽FQ 5min后,FRET信号迅速升高 (P<0.05)(图 2;图 7-2)。依据FRET原理,表明孤啡肽FQ能够诱导ORL1激活Gαi1蛋白,并引起并引起Gαi1亚基的α螺旋区域与Gγ2亚基N末端相互靠近。综上所述,Gαi1-YFP、Gβ1Gγ2-CFP重组质粒均能正常工作,Apelin受体活化时不能激活Gαi1蛋白。
|
图 1 Apelin-13未改变Gαi1与Gβ1Gγ2之间的FRET信号 注:图中由左至右所示CFP、YFP、FTET 3个通道获取的图像,分别在HEK293T细胞中瞬时转染 (a) peYFP-N1(0.15μg);(b) Gγ2-CFP (0.15μg);(c) peYFP-N1、Gγ2-CFP (0.15μg,0.15μg);(d) Gαi1-YFP (0.2μg);(e) APJ、Gαi1-YFP、Gβ1Gγ2-CFP (0.1μg,0.2μg,0.1μg,0.15μg) 所得。(e) 中获取2张FRET通道的图像,由左至右表示100nM Apelin-13刺激前、后的图像。 |

|
图 7 激动剂刺激前后FRET值的变化 注:1表示100nM Apelin-13刺激后对照组FRET的变化值;3、4、5、6表示100nM Apelin-13刺激后Apelin受体与Gαi1、Gαi3、Gαo、GαqFRET的变化值,2表示1μM Orphanin FQ刺激前后Apelin受体与Gαi2FRET的变化值,即△FRET[△FRET=FYFP/CFP (刺激后)-FYFP/CFP (刺激前)],与对照组相比,ns P>0.05,* P<0.05,** P<0.001 |
|
图 2 孤啡肽对Gαi1与Gβ1Gγ2之间FRET信号的影响 注:图中由左至右所示CFP、YFP、FTET 3个通道获取的图像,分别在HEK293T细胞中瞬时转染 (a) peYFP-N1(0.15μg);(b) Gγ2-CFP (0.15μg);(c) peYFP-N1、Gγ2-CFP (0.15μg,0.15μg);(d) Gαi1-YFP (0.2μg);(e) ORL、Gαi1-YFP、Gβ1Gγ2-CFP (0.1μg,0.2μg,0.1μg,0.15μg) 所得。(e) 中获取2张FRET通道的图像,由左至右表示1μM Orphanin FQ刺激前、后的图像。 |
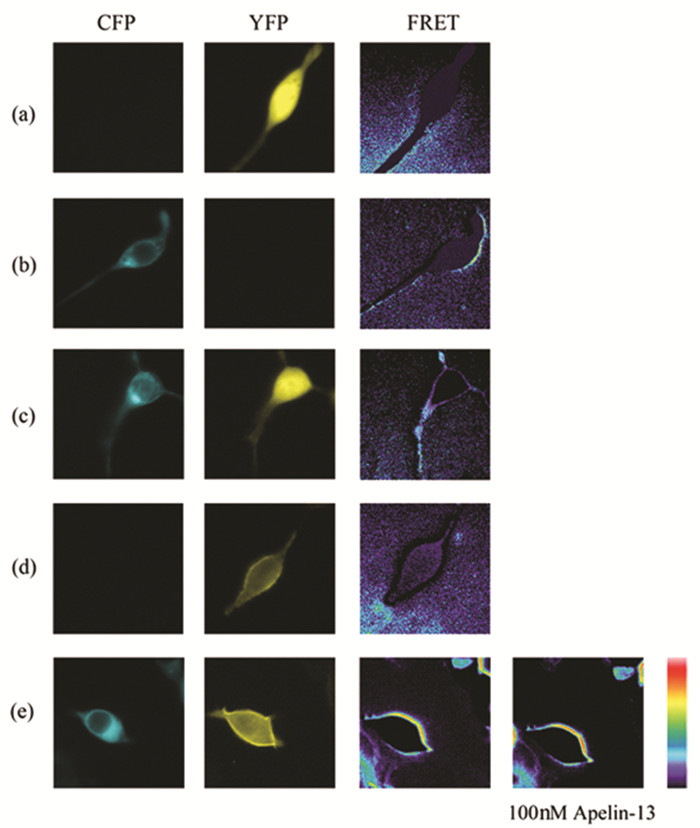
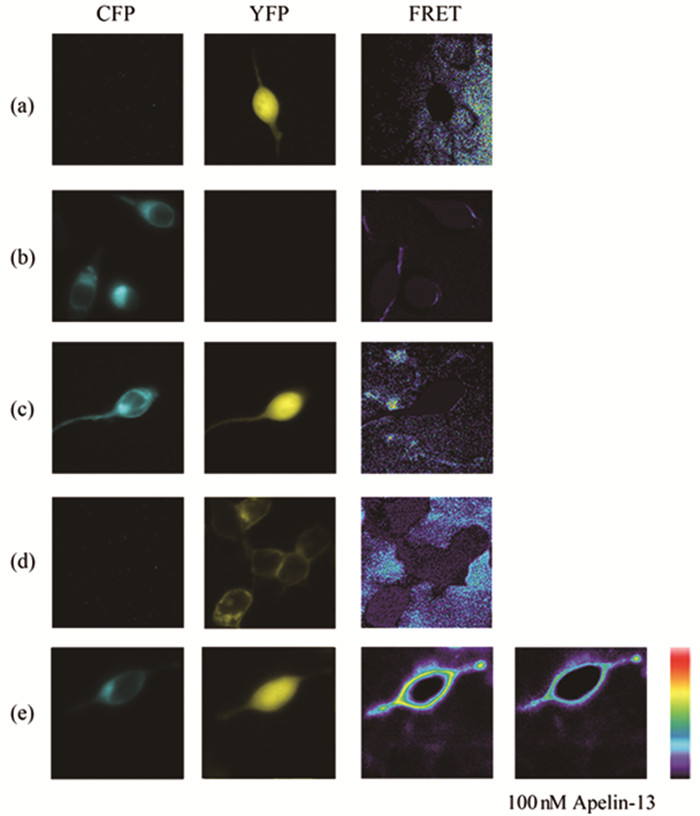
如前所述,在HEK293T细胞中瞬时共转染APJ、Gαi2-YFP、Gβ1Gγ2-CFP融合载体,当给予终浓度100nM的Apelin-13干预时,FRET通道的图像逐渐变黄,略显红色,FRET强度随之增强 (图 3;图 7-3)。依据FRET原理,表明Apelin-13活化Apelin受体后能够激活Gαi2亚基,并引起Gαi2亚基的αΑ-B-loop与Gγ2亚基的N末端区域相互靠近。实验组APJ、Gαi3-YFP、Gβ1Gγ2-CFP与之变化趋势相似,即:细胞膜区域由浅蓝色逐渐加深,浅蓝色区域变宽,且略微变黄,FRET效率也逐渐增强 (图 4;图 7-4)。依据FRET原理,证实Apelin-13刺激Apelin受体后能够激活Gαi3蛋白,并诱导其空间构象发生改变,即其α螺旋区域向Gγ2的N末端区域靠近。
|
图 3 FRET监测Gαi2与Gβ1Gγ2之间的相互作用 注:图中由左至右所示CFP、YFP、FTET 3个通道获取的图像,分别在HEK293T细胞中瞬时转染 (a) peYFP-N1(0.15μg);(b) Gγ2-CFP (0.15μg);(c) peYFP-N1、Gγ2-CFP (0.15、0.15μg);(d) Gαi2-YFP (0.2μg);(e) APJ、Gαi2-YFP、Gβ1Gγ2-CFP (0.1、0.2、0.1、0.15μg) 所得。(e) 中获取2张FRET通道的图像,由左至右表示100nM Apelin-13刺激前、后的图像。 |

|
图 4 FRET监测Gαi3与Gβ1Gγ2之间的相互作用 注:图中由左至右所示CFP、YFP、FTET 3个通道获取的图像,分别在HEK293T细胞中瞬时转染 (a) peYFP-N1(0.15μg);(b) Gγ2-CFP (0.15μg);(c) peYFP-N1、Gγ2-CFP (0.15、0.15μg);(d) Gαi3-YFP (0.2μg);(e) APJ、Gαi3-YFP、Gβ1Gγ2-CFP (0.1、0.2、0.1、0.15μg) 所得。(e) 中获取2张FRET通道的图像,由左至右表示100nM Apelin-13刺激前、后的图像。 |
在随后的研究中,我们发现在加入同等剂量的Apelin-13处理后,瞬时共转染Apelin受体、Gαo-YFP、Gβ1Gγ2-CFP重组质粒的实验组FRET信号减弱,细胞膜的黄色区域逐渐消失,淡蓝色区域变窄,FRET强度减弱 (图 5;图 7-5);瞬时共转染APJ、Gαq-YFP、Gβ1Gγ2-CFP重组质粒的FRET现象与此相似,细胞膜上淡蓝色区域变窄变弱,FRET强度降低 (图 6;图 7-6)。依据FRET原理,证实Apelin-13诱导Apelin受体激活Gαo、Gαq亚基,其活化后远离Gγ2亚基的N末端区域。
|
图 5 FRET监测Gαo与Gβ1Gγ2之间的相互作用 注:图中由左至右所示CFP、YFP、FTET 3个通道获取的图像,分别在HEK293T细胞中瞬时转染 (a) peYFP-N1(0.15μg);(b) Gγ2-CFP (0.15μg);(c) peYFP-N1、Gγ2-CFP (0.15、0.15μg);(d) Gαo-YFP (0.2μg);(e) APJ、Gαo-YFP、Gβ1Gγ2-CFP (0.1、0.2、0.1、0.15μg) 所得。(e) 中获取2张FRET通道的图像,由左至右表示100nM Apelin-13刺激前、后的图像。 |
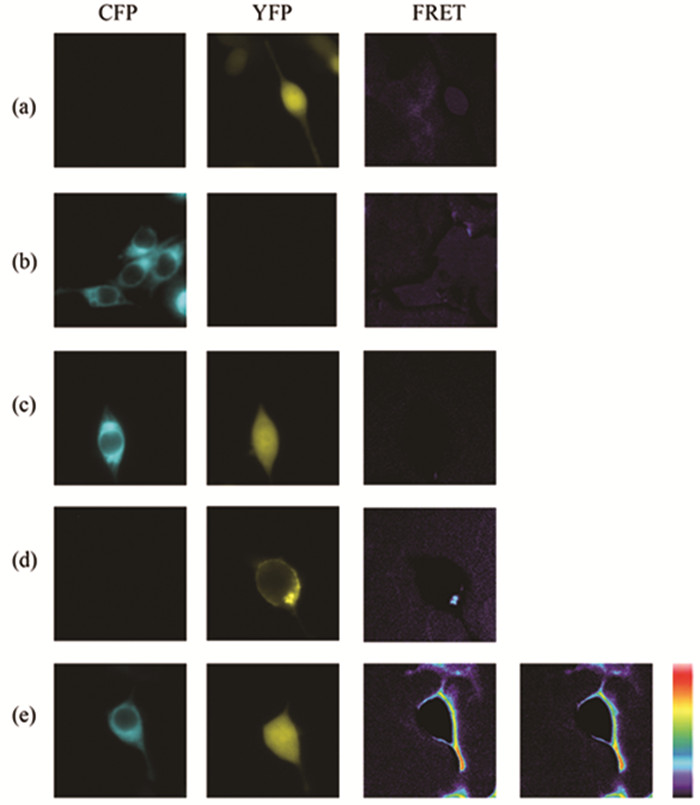
|
图 6 FRET监测Gαq与Gβ1Gγ2之间的相互作用 注:图中由左至右所示CFP、YFP、FTET 3个通道获取的图像,分别在HEK293T细胞中瞬时转染 (a) peYFP-N1(0.15μg);(b) Gγ2-CFP (0.15μg);(c) peYFP-N1、Gγ2-CFP (0.15、0.15μg);(d) Gαq-YFP (0.2μg);(e) APJ、Gαq-YFP、Gβ1Gγ2-CFP (0.1、0.2、0.1、0..15μg) 所得。(e) 中获取2张FRET通道的图像,由左至右表示100nM Apelin-13刺激前、后的图像。 |
Apelin受体作为上市药物约占30%的GPCRs[21]超家族成员之一,在中枢神经系统、心血管系统等具有重要的调节作用[22-23]。前期研究表明,Apelin受体能够激活Gαi2亚基抑制cAMP的生成,并介导ERK磷酸化[12],引起相应的胞内反应,但Apelin受体与G蛋白的偶联机制至今尚不清楚。传统观点认为,GPCRs在配体作用下诱导激活G蛋白,引起Gα与Gβγ亚基分离,活化的Gα与Gβγ亚基各自介导其下游信号通路[24]。近期研究发现,活化的G蛋白亚基之间没有彼此分离,而呈现出空间构象重排,如Bunemann等[25]发现Gαi/s蛋白活化后空间构象发生了变化。基于前期研究基础,本实验致力于探讨Apelin受体与G蛋白的相互作用关系,即Apelin受体能够激活哪一亚型的G蛋白及G蛋白的活化机制。
FRET技术是克服传统技术不能检测活细胞中大分子互作的缺点且具有高分辨率、高灵敏度等优点的新型技术[26-30]。基于FRET技术通过荧光蛋白光谱重叠完成两者间小于10nm时的互作,本实验引入青色荧光蛋白 (CFP) 与黄色荧光蛋白 (YFP) 分别作为能量供体与能量受体辅助完成Apelin受体与G蛋白相互作用的检测。此外,为降低自体荧光 (细胞培养液中的营养因子等在激发光下产生的荧光) 的干扰信号,本实验引入对照组计算校正系数更正FRET效率。实验中尽量采用低频率、较短的曝光时间来降低荧光淬灭现象。
本实验利用FRET技术在永生化HEK293T细胞中研究Apelin受体与G蛋白的相互作用,研究表明Apelin受体与Gαi1蛋白没有发生偶联。但在Masri等的研究中发现Apelin受体能够通过偶联大鼠的Gαi介导激活ERK途径,究其原因发现,本实验采用小鼠的Gαi基因序列与大鼠的Gαi基因序列虽然存在96%的序列同源,但其生物学性能却存在巨大差异,如Gαi1(C351Ⅰ) 突变体对PTX不敏感。为实时观察Apelin-13刺激前后,Apelin受体与G蛋白的相互作用产生的FRET现象的变化,本实验选用YFP嵌在Gαi1亚基的α螺旋区域 (aΑ-B-loop) 的重组质粒—Gαi1-YFP (C351Ⅰ),且对PTX不敏感。在HEK293T细胞中瞬时共转染APJ、Gαi1-YFP、Gβ1Gγ2-CFP重组质粒。FRET结果表明,激动剂Apelin-13刺激前后FRET信号几乎没有变化,但实验组 (共转染APJ、Gαi2/Gαi3-YFP、Gβ1Gγ2-CFP重组质粒的HEK293T细胞) 的FRET信号强于对照组 (peYFP-N1、Gγ2-CFP)。依据FRET原理,实时分析FRET数据,推测Apelin-13刺激Apelin受体后不能够激活Gαi1蛋白。为进一步证实Gαi1-YFP、Gβ1Gγ2-CFP等重组质粒是工作的,我们利用FRET技术监测孤啡肽受体 (orphan opioid-like receptor,ORL1) 与Gαi1蛋白的互作。瞬时共转染ORL1、Gαi1-YFP、Gβ1Gγ2-CFP的HEK293T细胞,依次获取刺激 (激动剂终浓度为1μM Orphanin FQ) 前后的FRET图像与数据,发现加入激动剂孤啡肽FQ 5min后,FRET信号迅速升高 (P<0.05)。依据FRET原理,表明孤啡肽FQ能够诱导ORL1激活Gαi1蛋白,并引起并引起Gαi1亚基的α螺旋区域与Gγ2亚基N末端相互靠近。综上所述,Gαi1-YFP、Gβ1Gγ2-CFP重组质粒均能正常工作,Apelin受体活化时不能激活Gαi1蛋白。
本实验前期研究表明,Apelin受体能够激活Gαi2蛋白,并引起下有信号通路ERK磷酸化[12],但Apelin受体诱导Gαi2蛋白的活化机制尚不清楚。本实验选用α螺旋区域插入YFP、PTX不敏感的Gαi2-YFP重组质粒,观察发现,当给予终浓度100nM的Apelin-13干预时,FRET通道的图像逐渐变黄,略显红色,FRET强度随之增强,表明Apelin-13活化Apelin受体后能够激活Gαi2亚基,并引起Gαi2亚基的αΑ-B-loop与Gγ2亚基的N末端区域相互靠近。Gαi3亚型是Gαi亚家族中另一个重要的G蛋白,虽然Apelin受体主要通过Gαi2蛋白介导其下游级联反应,为进一步研究Apelin受体可能存在的信号通路,本实验试图探明Apelin受体活化后是否偶联Gαi3亚基,以及其活化状态。Apelin-13处理后,其FRET信号的变化趋势与瞬时共转染APJ、Gαi2-YFP、Gβ1Gγ2-CFP重组质粒的HEK293T细胞的FRET信号变化趋势相似,即细胞膜区域由浅蓝色逐渐加深,浅蓝色区域变宽,且略微变黄,FRET效率也逐渐增强依据FRET原理,证实Apelin-13刺激Apelin受体后能够激活Gαi3蛋白,并诱导其空间构象发生改变,即其α螺旋区域向Gγ2的N末端区域靠近。
在接下来的研究中,我们发现,在瞬时共转染APJ、Gαo-YFP、Gβ1Gγ2-CFP重组质粒的HEK293T细胞的FRET信号与瞬时共转染APJ、Gαq-YFP、Gβ1Gγ2-CFP重组质粒的实验组的FRET信号变化趋势相似,但不同于APJ、Gαi1-YFP/Gαi2-YFP/Gαi3-YFP、Gβ1Gγ2-CFP实验组。在加入同等剂量的Apelin-13处理后,瞬时共转染APJ、Gαo-YFP、Gβ1Gγ2-CFP重组质粒的实验组FRET信号减弱,细胞膜的黄色区域逐渐消失,淡蓝色区域变窄,FRET强度减弱;瞬时共转染APJ、Gαq-YFP、Gβ1Gγ2-CFP重组质粒的FRET现象与此相似,细胞膜上淡蓝色区域变窄变弱,FRET强度降低。依据FRET原理,证实Apelin-13诱导Apelin受体激活Gαo、Gαq亚基,其活化后远离Gγ2亚基的N末端区域。
上述结果表明:Apelin受体能够同时激活Gαi2、Gαi3、Gαo、Gαq蛋白,但其活化机制不同,这为进一步研究Apelin受体介导的下游信号通路提供理论基础。
综上所述,本实验采用FRET技术使得实验数据真实可靠,进而能够客观的分析Apelin受体与G蛋白的作用机制。Apelin受体作为GPCRs家族中的研究热点之一,引起人们的广泛关注,本实验室以Apelin受体为中心展开了对其二聚体[19, 31]、与G蛋白互作、脱敏内化、信号转导、突变体[12]以及由Apelin介导的神经保护作用等逐步进行研究,并取得了一定的进展。由此探讨的Apelin受体与G蛋白的相互作用关系,希望能为相关研究提供可靠的理论基础。
| [1] | Loot AE, Fleming I. A novel APJ signaling cascade that regulates cardiovascular development[J]. Circ Res, 2013, 113(1): 4–6. DOI:10.1161/CIRCRESAHA.113.301632 |
| [2] | Dai L, Smith PM, Kuksis M, et al. Apelin acts in the subfornical organ to influence neuronal excitability and cardiovascular function[J]. J Physiol, 2013, 591(13): 3421–3432. DOI:10.1113/jphysiol.2013.254144 |
| [3] | Hosoya M, Kawamata Y, Fukusumi S, et al. Molecular and functional characteristics of APJ.Tissue distribution of mRNA and interaction with the endogenous ligand apelin[J]. J Biol Chem, 2000, 275(28): 21061–21067. DOI:10.1074/jbc.M908417199 |
| [4] | Kidoya H, Takakura N. Biology of the apelin-APJ axis in vascular formation, J.Biochem[J]. J Biochem, 2012, 152(2): 125–131. DOI:10.1093/jb/mvs071 |
| [5] | Tatemoto K, Hosoya M, Habata Y, et al. Isolation and characterization of a novel endogenous peptide ligand for the human APJ receptor[J]. Biochem Biophys Res Commun, 1998, 251(2): 471–476. |
| [6] | Japp AG, Newby DE. The apelin-APJ system in heart failure:pathophysiologic relevance and therapeutic potential[J]. Biochem Pharmacol, 2008, 75(10): 1882–1892. DOI:10.1016/j.bcp.2007.12.015 |
| [7] | He L, Xu J, Chen L, et al. Apelin/APJ signaling in hypoxia-related diseases[J]. Clin Chim Acta, 2015, 451: 191–198. DOI:10.1016/j.cca.2015.09.029 |
| [8] | Cao J, Li H, Chen L. Targeting drugs to APJ receptor:the prospect of treatment of hypertension and other cardiovascular diseases[J]. Curr Drug Targets, 2015, 16(2): 148–155. DOI:10.2174/1389450115666141128120053 |
| [9] | Wu D, He L, Chen L.Apelin/APJ system:a promising therapy target for hypertension[J].Mol Biol Rep, 2014, 41(10):6691-6703. DOI:10.1007/s11033-014-3552-4.Epub 2014 Jul 3. |
| [10] | Scimia MC, Hurtado C, Ray S, et al. APJ acts as a dual receptor in cardiac hypertrophy[J]. Nature, 2012, 488(7411): 394–398. DOI:10.1038/nature11263 |
| [11] | Yang L, Su T, Lv D, et al. ERK1/2 mediates lung adenocarcinoma cell proliferation and autophagy induced by apelin-13[J]. Acta Biochim Biophys Sin, 2014, 46(2): 100–111. DOI:10.1093/abbs/gmt140 |
| [12] | Chen X, Bai B, Tian Y, et al. Identification of serine 348 on the apelin receptor as a novel regulatory phosphorylation site in apelin-13-induced G protein-independent biased signaling[J]. J Biol Chem, 2014, 289(45): 31173–31187. DOI:10.1074/jbc.M114.574020 |
| [13] | Lohse MJ, Nuber S, Hoffmann C. Fluorescence/bioluminescence resonance energy transfer techniques to study G-protein-coupled receptor activation and signaling[J]. Pharmacol Rev, 2012, 64(2): 299–336. DOI:10.1124/pr.110.004309 |
| [14] | Azpiazu I, Gautam N. A fluorescence resonance energy transfer-based sensor indicates that receptor access to a G protein is unrestricted in a living mammalian cell[J]. J Biol Chem, 2004, 279(26): 27709–27718. DOI:10.1074/jbc.M403712200 |
| [15] | Tatemoto, Hosoya, Habata, et al. Isolation and characterization of a novel endogenous peptide ligand for the human APJ receptor, Biochem.Biophys[J]. Res.Commun, 1998, 251: 471–476. |
| [16] | Becker, Wallace, Garzon, et al. Ligands for kappaopioid and ORL1 receptors identified from a conformationally constrained peptide combinatorial library[J]. J Biol Chem, 1999, 274: 27513–27522. DOI:10.1074/jbc.274.39.27513 |
| [17] | 王琰, 饶烽, 崔钢华, 等. 基于FRET技术MMP-9生物传感器的构建及鉴定[J]. 中国细胞生物学学报, 2016, 38(4): 356–362. DOI:10.11844/cjcb.2016.04.0406 |
| [18] | 姜云璐, 龚磊, 白波, 等. G蛋白偶联受体与G蛋白相互作用的最新研究进展[J]. 生命科学, 2014, 26(2): 181–187. DOI:10.13376/j.cbls/2014027 |
| [19] | Bai B, Liu L, Zhang N, et al. Heterodimerization of human apelin and bradykinin 1 receptors:novel signal transduction characteristics[J]. Cell Signal, 2014, 26(7): 1549–1559. DOI:10.1016/j.cellsig.2014.03.022 |
| [20] | Chen J, Zhang R, Chen X, et al. Heterodimerization of human orexin receptor 1 and kappa opioid receptor promotes protein kinase A/cAMP-response element binding protein signaling via a Gαs-mediated mechanism[J]. Cell Signal, 2015, 27(7): 1426–1438. DOI:10.1016/j.cellsig.2015.03.027 |
| [21] | Gruber CW, Muttenthaler M, Freissmuth M. Ligand-based peptide design and combinatorial peptide libraries to target G protein-coupled receptors[J]. Curr Pharm Des, 2010, 16(28): 3071–3088. DOI:10.2174/138161210793292474 |
| [22] | George R, Emma M, Stephen J, et al. Central and peripheral apelin receptor distribution in the mouse:Species differences with rat[J]. Peptides, 2012, 33: 139–148. DOI:10.1016/j.peptides.2011.12.005 |
| [23] | Kleinz MJ, Skepper JN, Davenport AP. Immunocytochemical localisation of the apelin receptor, APJ, to human cardiomyocytes, vascular smooth muscle and endothelial cells[J]. Regul Pept, 2005, 126(3): 233–240. DOI:10.1016/j.regpep.2004.10.019 |
| [24] | 王焕南, 白波, 陈京. G蛋白偶联受体磷酸化研究进展[J]. 济宁医学院学报, 2016, 39(6): 416–420. DOI:10.3969/j.issn.1000-9760 |
| [25] | Bunemann M, Frank M, Lohse MJ. Gi protein activationin intact cells involves subunit rearrangement rather than dissociation[J]. Proc Natl Acad Sci USA, 2003, 100(26): 16077–16082. DOI:10.1073/pnas.2536719100 |
| [26] | 季丙元, 陈京, 白波, 等. pB2R-Venus重组真核载体的构建及在HEK293T细胞中的表达[J]. 济宁医学院学报, 2014, 37(5): 309–312. DOI:10.3969/j.issn.1000-9760 |
| [27] | 陈京, 姜云璐. GPCRs二聚体:功能和药理作用展望[J]. 济宁医学院学报, 2015, 38(1): 1–7. DOI:10.3969/j.issn.1000-9760 |
| [28] | 李瑞, 宋晓宁, 张华, 等. FRET技术研究PEG-PCL胶束跨MDCK细胞单层转运的完整性[J]. 药学学报, 2016, 51(8): 1316–1324. DOI:10.16438/j.0513-4870 |
| [29] | 刘伟, 曹微微, 何建伟, 等. 在活细胞中应用FRET技术研究TGFβ/TβRI信号转导[J]. 中国生物化学与分子生物学报, 2015, 31(7): 757–762. DOI:10.13865/j.cnki.cjbmb |
| [30] | 刘晓志, 赵会景, 陈伟斌, 等. 利用FRET技术研究Hepcidin和Fpn相互作用[J]. 中国生物工程杂志, 2011, 31(1): 56–60. |
| [31] | Yalin Li, Jing Chen, Bo Bai, et al. Heterodimerization of human apelin and kappa opioid receptors:Roles in signal transduction[J]. Cell Signal, 2012, 24(5): 991–1001. DOI:10.1016/j.cellsig |



